沧州市高一化学上册月考试卷题带答案和解析
| 1. 选择题 | 详细信息 |
|
若已发现了116号元素则下列推断正确的是:①其钠盐的化学式为Na2R ②其最高价氧化物对应的水化物的酸性比硫酸强③R是金属元素④R是非金属元素⑤最外电子层有6个电子 A. ①②③ B. ①③⑤ C. ②④⑤ D. ③⑤ |
|
| 2. 选择题 | 详细信息 |
已知 X、Y、Z、W 均为短周期元素,它们在周期表中的位置如图所示。下列说法正确的是 A.原子半径:W>X B.氢化物的热稳定性:W<Z C.元素 Y 与元素 Z 可形成化合物 YZ2 D.由氢化物水溶液的酸性:W>Z ,可推知元素的非金属性:W>Z |
|
| 3. 选择题 | 详细信息 |
|
短周期元素 A、B、C、D 的原子序数依次递增,它们的核电荷数之和 32,原子最外层电子数之和为 10,A与 C同主族,B与 D同主族,A、C原子最外层电子数之和等于 B 原子的次外层电子数,则下列叙述中正确的是 A.一定条件下,B 单质能置换出 D 单质,C 单质能置换出 A 单质 B.四种元素的原子半径:r(A)<r(B)<r(C)<r(D) C.B、D 的最高价氧化物中,B、D 与氧原子均为双键 D.D 元素处于元素周期表中第 3 周期第Ⅳ族 |
|
| 4. 选择题 | 详细信息 |
|
原子序数为 31 的元素 R,在周期表中的位置为 A.第三周期第VA族 B.第四周期第IIIA 族 C.第五周期第IIIA 族 D.第四周期第VA 族 |
|
| 5. 选择题 | 详细信息 |
|
W、X、Y、Z为原子序数依次增大的短周期主族元素,W最外层电子数是内层电子数的3倍,Y在短周期元素中原子半径最大,Z的最高正价与最低负价代数之和为4。下列说法不正确的是 A. 氢化物的稳定性:X > W > Z B. Z与W形成的某种物质能使品红溶液褪色 C. X与Y形成共价化合物 D. W与Y组成的某种物质可以作为呼吸面具的供氧剂 |
|
| 6. 选择题 | 详细信息 |
|
关于元素周期表,下列叙述中不正确的是( ) A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 B. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 C. 在元素周期表的左下角可以寻找制备新型农药材料的元素 D. 在地球上元素的分布和它们在元素周期表中的位置没有密切关系 |
|
| 7. 选择题 | 详细信息 |
|
短周期主族元素X、Y、Z、W、R原子序数依次增大,X-的电子层结构与氦相同,Y是地壳中含量最多的元素,Y2-和Z+的电子层结构相同, W的最高化合价为最低化合价绝对值的3倍,W与R同周期,R的原子半径小于W。下列说法不正确的是 A. 元素的非金属性次序为R>W>X B. Z和其他4种元素均能形成离子化合物 C. 离子半径:W2-> Y2-> Z+ D. 氧化物的水化物的酸性:W<R |
|
| 8. 选择题 | 详细信息 |
|
自然界中氯化钠是由1123Na 与1735Cl 和1735Cl所构成的。已知氯元素的相对原子质量是35.5,则 11.7g 氯化钠中,含1735Cl 的质量为 A.1.75g B.1.85g C.5.25g D.5.55g |
|
| 9. 选择题 | 详细信息 |
|
下列说法正确的是 A.红磷、白磷属于同分异构体 B.H2、D2 属于同素异形体 C.1940K、2040Ca 互为同位素 D.H、D、T 互为同位素 |
|
| 10. 选择题 | 详细信息 |
|
X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同。下列说法不正确的是 A. 离子半径:X+> Y3+> Z2- B. 碱性:XOH > Y(OH)3 C. 单质的还原性:X > Y D. 原子序数:Y > X > Z |
|
| 11. 选择题 | 详细信息 |
|
下列各组物质中,均属于共价化合物并且化学键类型完全相同的是 A.N2 和 H2 B.H2S 和 CO2 C.O2 和 CCl4 D.HNO3 和 NH4NO3 |
|
| 12. 选择题 | 详细信息 |
|
下列说法中正确的是 A.离子键就是阴、阳离子间的静电引力和静电斥力 B.所有金属元素与所有非金属元素间都能形成离子键 C.钠原子与氯原子结合形成离子键 D.在离子化合物 CaCl2 中,两个氯离子间也存在离子键 |
|
| 13. 选择题 | 详细信息 |
|
下列用电子式表示化合物的形成过程,正确的是 A. B. C. D. |
|
| 14. 选择题 | 详细信息 |
|
下列说法正确的是 A.CO2、BF3、PCl3分子中所有原子都满足最外层 8 电子结构 B.NaOH、Na2O2、CaC2中既含离子键又含共价键 C.已知0.75molRO32-中有30mol电子,则R在元素周期表中第三周期ⅥA 族 D.氯化铵受热固体消失和干冰升华都需克服分子间作用力 |
|
| 15. 选择题 | 详细信息 |
|
根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g) △H=-297.23kJ/mol分析下列说法中不正确的是 A. S(g)+O2(g)=SO2(g)放出的热量等于297.23kJ B. S(g)+O2(g)=SO2(g)放出的热量大于297.23kJ C. 1molS(s)完全燃烧放热为297.23kJ D. 形成1molSO2(g)的化学键释放的总能量大于断裂1molS(s)和1molO2(g)的化学键所吸收的总能量 |
|
| 16. 选择题 | 详细信息 |
|
下列反应中属于放热反应的个数是 ①酸碱中和反应 ②碳和水蒸气高温生成CO和H2的反应 ③NH4Cl固体和Ba(OH)2·8H2O固体的反应 ④铝热反应 ⑤Na与水的反应 ⑥铁在Cl2中燃烧 ⑦Mg和CO2的反应 A. 2 B. 3 C. 4 D. 5 |
|
| 17. 选择题 | 详细信息 |
|
将 4 molA 和 2 molB 在 2 L 的容器中混合并在一定条件下发生如下反应 2A(g)+B(s)=2C(g),若经2s后测得 C 的浓度为 0.6 mol/L,现有下列几种说法: ①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s) ②用物质 B 表示的反应的平均速率为 0.6 mol/(L·s) ③增大 B 的浓度可加快反应速率 ④2 s 时物质 A 的浓度为 1.4 mol/L 其中正确的是 A.①③ B.①④ C.②③ D.③④ |
|
| 18. 选择题 | 详细信息 |
|
向体积为 1L 的恒温恒容密闭容器中充入 2molA,发生反应:A(g) A.大于 10s B.10s C.小于 10s D.无法判断 |
|
| 19. 选择题 | 详细信息 |
|
对于可逆反应 A(g)+3B(s) A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1 C.v(C)=0.1 mol·L-1·s-1 D.v(D)=0.4 mol·L-1·min-1 |
|
| 20. 选择题 | 详细信息 |
|
在 一 定 条 件 下 , 使10molSO3 在 体 积 固 定 为 2L 的 密 闭 容 器 中 发 生 反 应 :2SO2(g)+O2(g) A.  B. B. C.  D. D. |
|
| 21. 选择题 | 详细信息 |
|
在一个密闭容器中发生反应:2SO2(g)+O2(g) A. c(O2)=0.2mol/L B. c(SO2)=0.25mol/L C. c(SO2)+c(SO3)=0.3mol/L D. c(SO2)=c(SO3)=0.15mol/L |
|
| 22. 选择题 | 详细信息 |
|
H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s) A. ①③⑤ B. ①③④ C. ②④ D. ①④ |
|
| 23. 选择题 | 详细信息 |
关于如图所示装置的叙述,正确的是  A.该装置构成原电池,锌易失电子作负极、Cu 作正极,负极上电极反应式为 Zn-2e-=Zn2+,所以锌的质量逐渐减少 B.电流从负极锌沿导线流向正极铜 C.该装置是将电能转化为化学能的装置,为原电池 D.氢离子在锌片上被还原,所以锌片上有气泡生成 |
|
| 24. 选择题 | 详细信息 |
|
研究人员最近发现了一种“水电池”,这种电池能利用淡水与海水之间含盐量的差别进行发电, 在海水中电池总反应式为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列对“水电池”在海水中放电时的有关 说法正确的是 A.正极反应式为:5MnO2+2e-=Mn5O102- B.每生成 1 mol AgCl 转移 2 mol 电子 C.工作时,电子由 MnO2 极经外电路流向 Ag 极 D.Ag 发生还原反应 |
|
| 25. 选择题 | 详细信息 |
|
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为( ) A.57 B.47 C.61 D.293 |
|
| 26. 综合题 | 详细信息 |
|
(1)以下反应:①木炭与水制备水煤气,②氯酸钾分解,③炸药爆炸,④酸与碱的中和反应,⑤生石灰与水作用制熟石灰,⑥Ba(OH)2•H2O 与 NH4Cl ,⑦浓硫酸溶于水, 属于放热反应__________.(填序号) (2)Mg-Al-NaOH 电池中的负极反应:___________. (3)FeCl3 溶液常用于腐蚀印刷电路铜板,发生 2FeCl3+Cu=2FeCl2+CuCl2,若将 此反应设计成原电池,则负极所用电极材料为___________,当线路中转移 0.2mol 电 子时,则被腐蚀铜的质量为___________g. (4)已知拆开 1mol H-H 键、1mol N≡N、1mol N-H 键分别需要吸收的能量为 436kJ、946k J、391k J.则由 N2 和 H2 反应生成 1mol NH3 需要放出___________的热量。 (5)用序号回答:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥P4 ⑦NH3•H2O ⑧Na2O2 ⑨HClO⑩CaO⑪HF⑫MgCl2 属于共价化合物的是___________,存在非极性键的是___________。 |
|
| 27. 推断题 | 详细信息 |
|
冬季下雪后,城市道路常使用融雪剂,其主要成分的 化学式为 XY2,X、Y 均为周期表前 20 号元素,其阳离子和阴离子电子层结构相同,且 1 mol XY2 含有 54 mol 电子。 (1)该融雪剂的化学式是___________,该物质中化学键类型是___________。 (2)元素 D、E 原子的最外层电子数是其电子层数的 2 倍,D 与 Y 相邻,则 D 的 离子结构示意图是___________;D 与 E 能形成一种结构类似于 CO2 的三原子 分子,且每个原子均达到了 8e-稳定结构,该分子的电子式为___________, 化学键类型为___________ (填“离子键”或“共价键”)。 (3)W 是与 D 同主族的短周期元素,Z 是第三周期金属性最强的元素,Z 的单质 在 W 的常见单质中反应时有两种产物:不加热时生成___________,其化学键类型为___________;加热时生成___________,其化学键类型为___________,电子式为___________。 |
|
| 28. 综合题 | 详细信息 |
|
(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 NO 和 NH3,在 一定条件下发生反应:6NO(g) + 4NH3(g) ①能说明该反应已达到平衡状态的标志是 ___________ a.反应速率 v( NH3) =v( N2) b.容器内压强不再随时间而发生变化 c.容器内 N2 的物质的量分数不再随时间而发生变化 d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6 e.12molN-H 键断裂的同时生成 5mol N≡N 键 f.混合气体的总质量不随时间的变化而变化 ②某次实验中测得容器内 NO 及 N2 的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆) (填﹥、﹤或﹦)。  (2)298 K 时,若已知生成标准状况下 2.24LNH3时放出热量为 4.62kJ。写出合成氨反应的热化学方程式___________。在该温度下,取 1molN2和 3mol H2 放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于 92.4 kJ, 其原因是___________。 (3)一定条件下,在 2L密闭容器内,反应 2NO2(g) 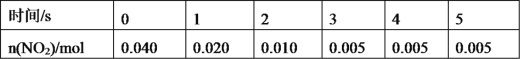 ①用 N2O4 表示 0~2 s 内该反应的平均速率为__________。在第 5s 时,NO2 的转化 率为____________。(转化率是指某一反应物转化的百分率。) ②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________。 |
|
最近更新



