2020年高三下册化学专题练习带参考答案与解析
| 1. 填空题 | 详细信息 |
|
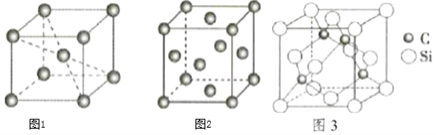
锂的某些化合物是性能优异的材料。请回答: (1)如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为 ______ ,其中  (2) (3)氮化锂是一种良好的储氢材料,其在氢气中加热时可吸收氢气得到氨基锂 (4)金属锂为体心立方晶胞,其配位数为 ______ ;若其晶胞边长为a pm,则锂晶体中原子的空间占有率是 ______ 。 (5)有机锂试剂在有机合成中有重要应用,但极易与 A.CO2中σ键与π键的数目比为1:1 B.游离态和化合态锂元素均可由特征发射光谱检出 C.叔丁基锂(C4H9Li)中碳原子的杂化轨道类型为sp3和sp2。 |
|
| 2. 填空题 | 详细信息 | ||||||||||
|
中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题: (1)基态铁原子的价层电子轨道表达式为______。 (2)硅、碳位于同一主族,用“
|
|||||||||||
| 3. 填空题 | 详细信息 |
硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题: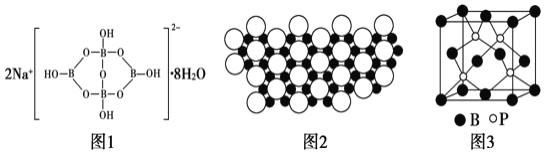 |
|
| 4. 综合题 | 详细信息 |
|
由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。 (1)钛元素基态原子未成对电子数为____个,能量最高的电子占据的能级符号为__。 (2)磷的一种同素异形体—白磷(P4)的立体构型为____,推测其在CS2中的溶解度____(填“大于”或“小于”)在水中的溶解度。 (3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:________。 (4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:______。 (5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____,已知晶体的密度为pg·cm-3,阿伏加德罗常数为NA,则晶胞边长为____cm(用含p、NA的式子表示)。  |
|
| 5. 填空题 | 详细信息 |
|
铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(﹣NO2)还原为氨基(﹣NH2);在苯的溴代反应中用溴化铁作催化剂。 (1)N的原子结构示意图为_______,Fe基态原子核外电子排布式为_______。 (2)H、N、O 的电负性从小到大的顺序是_______。 (3)与NO2+互为等电子体的一种分子为_____(填化学式),氨基(﹣NH2)中氮原子的杂化类型为_____。 (4)1mol苯分子中含有σ键的物质的量为______。 (5)Fe 与 N 形成的某化合物晶胞如图所示,则该晶体的化学式为_______。 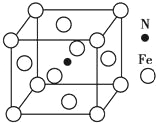 |
|
| 6. 推断题 | 详细信息 |
A、B、C、D为前四周期元素.A元素的原子价电子排布为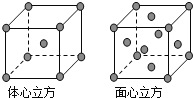 |
|
| 7. 推断题 | 详细信息 |
|
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高。请回答下列问题: (1)W原子L层电子排布式为__________________W3空间构形是__________________ (2)X单质与水反应的主要化学方程式______________________ (3)化合物M的化学式______________其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是__________________________。将一定是的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有____________________,O-C-O的键角约__________ (4) X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X:Y:Z=_________________。 (5)含有元素Z的盐的焰色反应为________色,许多金属盐都可以发生焰色反应,其原因是___________________________________________ (6) ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________________________________________g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为____________pm。 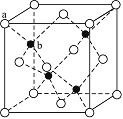 |
|
| 8. 综合题 | 详细信息 |
|
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题: (1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______________方法区分晶体、准晶体和非晶体。 (2)Fe的基态原子有________个未成对电子,Fe3+的电子排布式为__________________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为__________。 (3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1mol乙醛分子中含有的σ键的数目为__________。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。 (4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为________。列式表示Al单质的密度_________________________________________________g/cm3(不必计算出结果)。 |
|
| 9. 推断题 | 详细信息 |
|
(1)某第三周期金属元素R的部分电离能情况如图Ⅰ所示,则R元素位于正确表第____族,其基态原子第二能层电子排布图为_____________________。 图Ⅱ中 A、B、C、D是四种不同主族元素的气态氢化物,其中A比B分子沸点高的可能原因是_________。 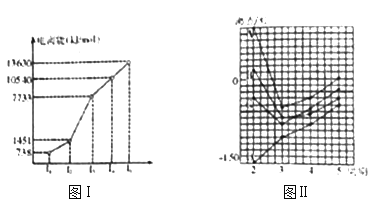 图Ⅱ中C物质能与第二周期中的另一种元素的氢化物通过配位键相互作用得到化合物X,X是一种储氢材料,且X是乙烷的等电子体,加热X会缓慢释放H2同时生成化合物Y,Y又是乙烯的等电子体,则化合物C的VSEPR模型是__________,X的结构式为__________(标明配位键)。 (2)已知Ti3+可形成配位数为6的配合物。 现有钛的两种配合物,组成皆为TiCl3·6H2O,一种为紫色,另一种为绿色,现取等质量的两种物质的样品配成待测溶液,分别往待测溶液中滴入AgNO3溶液充分反应,产生白色沉淀;测得绿色物质得到的沉淀质量是紫色物质得到的沉淀质量的2/3。则原绿色配合物的化学式为_____________,原紫色配合物的化学式为_____________。 (3)由某原子构成的晶胞,己知晶胞密度为ρg/cm3,边长为anm。若该原子半径为( |
|
| 10. 综合题 | 详细信息 |
|
铜、镁、金等的相关物质在生产生活中具有重要的作用。回答下列问题: (1)铜元素在周期表中的位置是___________,基态铜原子中,核外电子占据最高能层的符号是___________,占据该最高能层的电子数为___________。 (2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、 Cu5Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___________(填“晶体”或“非晶体”) (3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,lmol(SCN)2分子中含有σ键的数目为___________。(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种。理论上前者沸点低于后者,其原因是____________________________________________。 (4)铜与金形成的金属互化物的晶胞结构如图1所示,其晶胞边长为anm,该金属互化物的密度为___________(用含a、NA的代数式表示)g·cm-3。 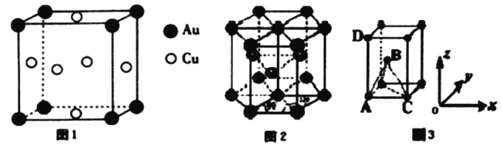 (6)某金属晶体中原子的堆积方式为六方最密堆积如图2所示,晶胞可用图3表示。已知该金属的原子半径为acm,该金属晶胞的高为bcm:若以晶胞中A点原子为原点建立空间直角坐标系o-xyz,则A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为______________________。 |
|
| 11. 推断题 | 详细信息 |
|
X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为 请回答下列问题:  |
|
| 12. 填空题 | 详细信息 |
硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用。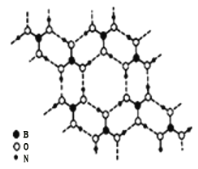 |
|
最近更新