2018-2019年高一上册期中考试化学题开卷有益(湖北省随州一中)
| 1. 选择题 | 详细信息 |
|
当我们外出旅游的时候,在车站会看到这样的告示:严禁携带易燃、易爆、剧毒品、易腐蚀品等上车。现有:①浓硫酸 ②纯碱 ③酒精 ④鞭炮 ⑤汽油 ⑥白磷等物质, 其中,旅客可带上车的有( ) A. ②③ B. ①②④⑤⑥ C. 只有② D. ①②④ |
|
| 2. 选择题 | 详细信息 |
|
下列实验方法或实验操作不正确的是( ) A. 在蒸馏时应先打开冷凝水开关,待水充满后再点燃酒精灯 B. 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 C. 酒精着火时可用湿抹布或沙子扑火 D. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 |
|
| 3. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是 ( ) A. 金属铜投入稀硫酸中:Cu+2H+=Cu2++H2↑ B. 氧化镁与稀盐酸混合:O2-+2H+=H2O C. 用碳酸氢钠治疗胃酸过多:CO32-+2H+=CO2↑+H2O D. 碳酸钙溶于稀盐酸中: CaCO3+2H+=Ca2++H2O+CO2↑ |
|
| 4. 选择题 | 详细信息 |
|
下列有关胶体的说法正确的是( ) A. 通过电泳实验证明胶体带电 B. 通常利用丁达尔效应区别溶液与胶体 C. 利用过滤方法可以将 NaCl、淀粉的水溶液分离 D. 向煮沸的NaOH溶液中滴加几滴饱和FeCl3溶液可制备Fe(OH)3胶体 |
|
| 5. 选择题 | 详细信息 |
|
下列各组离子在给定的条件下一定能大量共存的是( ) A. 在无色溶液 中:K+、MnO4-、SO42-、CO32- B. 在强碱性溶液中:Na+、K+、Fe3+、SO42- C. 含 Ca2+的溶液中:Na+、K+、Cl-、NO3- D. 在强酸性溶液中:K+、NH4+、Cl-、HCO3- |
|
| 6. 选择题 | 详细信息 |
|
用 NA 表示阿伏加德罗常数的值,下列说法正确的是( ) A. 22.4 L 一氧化碳中含有的分子数为NA B. 标准状况下,11.2 L H2O 含有的分子数为 0.5 NA C. 14gN2 和 CO 的混合气体中所含原子数为NA D. 1molFe 与足量的稀硫酸反应转移的电子数为 3 NA |
|
| 7. 选择题 | 详细信息 |
|
如图实验操作装置正确的是( ) A.  B. B. 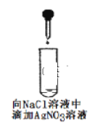 C. C.  D. D. 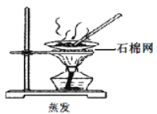 |
|
| 8. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||
下列关于物质分类的正确组合是( )
|
|||||||||||||||||||||||||||||||
| 9. 选择题 | 详细信息 |
如图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a值等于( ) A. 2 B. 3 C. 4 D. 5 |
|
| 10. 选择题 | 详细信息 |
|
下列溶液中物质的量浓度一定为 1mol/L 的是( ) A. 将 160g CuSO4 溶解在 1L 水中 B. 将 22.4LHCl 气体溶于水配成 1L 溶液 C. 从 1L2mol/L 的硫酸溶液中取出 0.5L D. 将 10g NaOH 溶解在少量水中,再加蒸馏水直到溶液体积为 250mL |
|
| 11. 选择题 | 详细信息 |
|
相同温度和压强下,3体积的X2气体与6体积的Y2气体化合生成6体积的气态化合物A,则生成物A的化学式为 ( ) A. XY2 B. X3Y2 C. X2Y3 D. XY |
|
| 12. 选择题 | 详细信息 |
|
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤正确的操作顺序是( ) A. ③②①⑤④ B. ①②③⑤④ C. ②③①④⑤ D. ③⑤②①④ |
|
| 13. 选择题 | 详细信息 |
|
下列有关氧化还原反应的说法正确是 ( ) A. 非金属单质在反应中只能做氧化剂 B. 氧化反应一定先于还原反应发生 C. 氧化还原反应的本质是元素化合价的升降 D. 铝久置于空气表面形成致密的薄膜,该过程发生了氧化还原反应 |
|
| 14. 选择题 | 详细信息 |
|
已知下述三个实验均能发生化学反应: ①将铁钉放入 CuSO4 溶液中:Fe+CuSO4=Cu+FeSO4; ②向硫酸亚铁溶液中滴入几滴浓硝酸:3FeSO4+6HNO3=Fe2(SO4)3+Fe(NO3)3+3NO2↑+3H2O; ③将铁钉放入氯化铁溶液中:Fe+2FeCl3=3FeCl2; 下列判断正确的是( ) A. 实验①和③中的铁钉只做还原剂 B. 实验②中 Fe2+既显氧化性又显还原性 C. 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ D. 实验③中反应的离子方程式为:Fe+Fe3+=2Fe2+ |
|
| 15. 选择题 | 详细信息 |
|
44gA 和 49gB 恰好完全反应生成 76gC 和一定量的气体 D,若 D 的相对分子质量为 34, 则生成气体 D 在标准状况下的体积为( ) A. 22.4L B. 11.2L C. 5.6L D. 44.8L |
|
| 16. 选择题 | 详细信息 |
|
己知在碱性溶液中可发生如下反应: 2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( ) A. +3 B. +4 C. +5 D. +6 |
|
| 17. 填空题 | 详细信息 |
|
完成下列填空: (1)要使 NH3 与 CH4 含相同数目的 H 原子,则 NH3 和 CH4 的物质的量之比为_______。 (2)19g 某二价金属氯化物(ACl2)中含有 0.4mol Cl−, ACl2 的化学式是_____。 (3)在标准状况下,V L H2 中含有 N 个氢分子,则阿伏加德罗常数为_____mol-1。 (4)实验室某盐酸试剂的密度为 1.19g/mL,质量分数为 36.5%,则该盐酸的物质的量浓度为_____mol·L-1。 |
|
| 18. 填空题 | 详细信息 |
|
现有下列八种物质:①Cu ②CaO ③稀硝酸④Ba(OH)2 固体⑤CO2⑥NaHSO4固体⑦氨水⑧Al2(SO4)3 (1)上述物质中属于电解质的是__________(填序号)。 (2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为________。 (3)⑧在水中的电离方程式为________。 (4)少量的⑤通入澄清石灰水中反应的离子方程式为________。 (5)将④的溶液逐滴加入到⑥的溶液中,恰好使溶液呈中性的离子方程式为________。 |
|
| 19. 填空题 | 详细信息 |
|
完成下列填空: (1)研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5 价砷(As)元素,但它对人体是无毒的,砒霜的成分是 As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素 C=砒霜。该使人中毒过程中维生素 C 是________填“氧化剂”或“还原剂)As2O3 是_______填“氧化产物”或“还原产物” ) (2)己知反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,标况下生成 3.36LNO,被还原的硝酸的物质的量为________mol,此时转移电子的物质的量_______mol。 (3)已知反应:3NO2+H2O=2HNO3+NO,该反应的离子方程式为_______该反应中氧化剂与还原剂的质量比为_______。 |
|
| 20. 实验题 | 详细信息 |
|
某溶液的溶质离子可能含有Mg2+、Ba2+、CO32-、Cl-、SO42-、NO3-中的几种,现进行如下实验: 1.取适量溶液,加入足量NaOH溶液,生成白色沉淀; 2.过滤,向实验1所得的滤液中加入足量H2SO4溶液,有白色沉淀生成。根据上述实验回答下列问题。 (1)溶液中一定不存在的离子是 (2)写出1和2中所发生反应的离子方程式 (3)为了验证溶液中是否存在Cl-、NO3- ,某同学提出下列假设: ①只存在Cl- ;②Cl-、NO3-同时存在;③ 。 已知实验提供的试剂只有稀盐酸、AgNO3溶液、稀硝酸、NaOH溶液和蒸馏水。 实验方法: 实验现象: 实验结论:假设③正确 |
|
| 21. 实验题 | 详细信息 |
|
实验题 Ⅰ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请 回答下列问题:  (1)指出提取碘的过程中有关实验操作①和③的名称:________;________。 (2)在 3 mL 碘水中,加入 1 mL 四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________ (注:试管中深色区为紫红色溶液)。 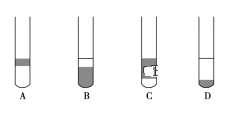 Ⅱ.欲配制 480mL0.5mol·L-1 的 NaOH 溶液,试回答下列问题。 (3)配制上述溶液需要的仪器有:药匙、托盘天平、量筒、玻璃棒、________。 (4)应称取的 NaOH 固体的质量为________ g。 (5)某学生实际配制的 NaOH 溶液的浓度为 0.51mol·L-1,原因可能是_________。 A.使用滤纸称量 NaOH 固体 B.容量瓶中原来存有少量水 C.溶解后的烧杯未经多次洗涤 D.用胶头滴管加水定容时俯视刻度 E.加水时超过刻度线,用胶头滴管吸出 F.转移溶液之前未经冷却 |
|
最近更新



