2018-2019年高一下半年第一次联考化学试卷(辽宁省凌源市)
| 1. 选择题 | 详细信息 |
|
下列分散系中,分散质粒子直径最小的是( ) A. 稀豆浆 B. 石灰乳 C. 稀硫酸 D. Fe(OH)3胶体 |
|
| 2. 选择题 | 详细信息 |
|
下列物质露置于空气中不易变质的是 A. NaCl溶液 B. |
|
| 3. 选择题 | 详细信息 |
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )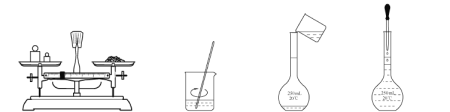 A.称量 B.溶解 C.转移 D.定容 |
|
| 4. 选择题 | 详细信息 |
|
下列金属中,常温下能被浓HNO3溶解的是( ) A. Al B. Ag C. Fe D. Au |
|
| 5. 选择题 | 详细信息 |
下列结构示意图中表示阳离子的是( ) A. A B. B C. C D. D |
|
| 6. 选择题 | 详细信息 |
|
下列说法错误的是( ) A. 浓硝酸与碳反应会产生红棕色气体 B. 试管内壁上附着的硫可用二硫化碳洗去 C. 工业上利用N2与H2反应进行氮的固定 D. 实验室用加热NH4Cl晶体的方法制取NH3 |
|
| 7. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 B. 任何元素的原子都是由核外电子和核内中子、质子构成的 C. 钠原子失去一个电子后变成了氖原子 D. |
|
| 8. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 金属在氯气中燃烧都有棕黄色的烟产生 B. 氯气为黄绿色有毒气体,与铁反应生成氯化亚铁 C. 氯气不能使干燥的有色布条褪色 D. 可通过下图装置除去Cl2中的HCl 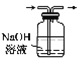 |
|
| 9. 选择题 | 详细信息 |
|
下列物质中,不能用单质直接化合生成物质是( ) A. FeCl2 B. CO C. SO2 D. NO |
|
| 10. 选择题 | 详细信息 |
|
下列关于某些氧化物的说法正确的是( ) A. NO2、Na2O2都能与水发生氧化还原反应 B. NO、CO2均可用向上排空气法收集 C. CO2、SO2可用澄清石灰水鉴别 D. CO2、SO3都可由相应单质在O2中燃烧生成 |
|
| 11. 选择题 | 详细信息 |
|
下列关于碱金属元素的叙述中错误的是( ) A. 单质在空气中燃烧产物中均呈+1价 B. 单质都能与水反应生成氢气和碱 C. 从锂到铯,原子半径逐渐增大,金属性增强 D. 单质中锂的密度最小、铯的熔点最高 |
|
| 12. 选择题 | 详细信息 |
|
NA为阿伏伽德罗常数的值,下列说法正确的是( ) A. 常温常压下,11.2L NH3中含有的氢原子数为1.5NA B. 1 mol Fe被氧化时,失去的电子数一定为3NA C. 0.1 mol/LHNO3溶液中含有NO3-数为0.1NA D. 7.8g Na2O2与足量水反应后转移的电子数为0.1NA |
|
| 13. 选择题 | 详细信息 |
|
下列离子方程式中,正确的是( ) A. 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ B. 氯气与FeBr2溶液反应:2Br-+Cl2=2Cl-+Br2 C. NO2与H2O反应:NO2+H2O=2H++NO3- D. FeC13溶液与NaOH溶液反应:Fe3++3OH-=Fe(OH)3↓ |
|
| 14. 选择题 | 详细信息 |
|
某固体物质和某溶液在一定条件下反应,产生气体的平均相对分子质量为45.8,则发生反应的物质不可能是( ) A. Zn和浓H2SO4 B. C和HNO3 C. Na2O2和NH4Cl浓溶液 D. Cu和浓HNO3 |
|
| 15. 实验题 | 详细信息 |
实验是化学研究的一种重要手段,现有如图所示A~E五种仪器,请根据要求填空。 (1)写出仪器名称:C__________,E_________。 (2)下列实验操作中用到仪器E的是___________(填字母)。 a.分离水和CCl4的混合物 b.分离水和酒精的混合物 c.分离水和泥沙的混合物 d.分离NaCl溶液中的NaCl和水 (3)仪器A~E中使用前必须检查是否漏水的是_________。 (4)若利用下图装置分离四氯化碳和酒精的混合物,则还缺少的仪器是____________,加热前应先在圆底烧瓶中加入几粒沸石,目的是_________________________;冷凝管的进水口是________(填“f”或“g”)。  |
|
| 16. 综合题 | 详细信息 |
|
氮元素的单质和常见的化合物在工、农业生产中用途广泛。NH3、NH3·H2O、NH4Cl、HNO3是最常见的含氮化合物。 (1)氮气常用作食品袋中填充气和某些场合下的保护气,与此相关的氮气的性质是______。 (2)上述4种含氮化合物中,属于盐的是_________,属于碱的是___________。 (3)NH3常用作制冷剂,其在空气中与HCl相遇产生白烟,这里“白烟”是_________,打开盛浓硝酸的试剂瓶塞,瓶口有白雾出现,这里“白雾”是___________。 (4)Fe粉与稀硝酸反应生成硝酸铁的化学方程式为________________________。该反应中硝酸表现出的化学性质主要有_____________________。 |
|
| 17. 综合题 | 详细信息 |
元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、M、Q、R分别代表某一化学元素。请用所给元素回答下列问题: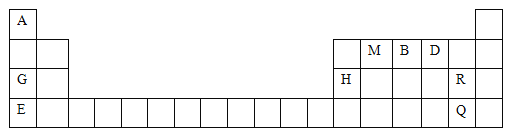 (1)写出下列元素的符号:B______、D________、H________。 (2)M元素的原子结构示意图为__________________。 (3)Q元素在元素周期表中的位置为_____________。Q的单质常温下为_________色液体,氧化性比R的单质氧化性__________(填“强”或“弱”)。 (4)G与E中金属性较强的是_________(填元素符号),其理由是__________________。 |
|
| 18. 实验题 | 详细信息 |
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答下列问题: (1)装置A中发生反应的化学方程式为________________________。 (2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是_____,其作用是______。 (3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________________。B中应放置的液体是___(填字母)。 a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液 (4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。 ①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。 ②下列药品中能用来证明反应结束后的圆底烧瓶中确有余酸的是_________(填字母)。 a.铁粉 b.BaC12溶液 c.银粉 d.Na2CO3溶液 |
|
| 19. 填空题 | 详细信息 |
|
氢化钠(NaH)和硝酸铵在工农业生产中有重要应用。 (1)氢化钠(NaH)中氢元素的化合价为___________。 (2)NaH能与水烈反应:NaH+H2O=NaOH+H2↑,氧化剂与还原剂的物质的量之比是____。 (3)金属与稀硝酸反应通常生成NO,硝酸更稀时,还可生成NH4NO3。写出镁与稀硝酸反应(HNO3仅被还原为NO)的化学方程式:____________________________________,若镁与稀硝酸反应时HNO3的还原产物仅为NH4NO3,则每生成1mol NH4NO3消耗HNO3的物质的量为________。 |
|
| 20. 填空题 | 详细信息 |
(14分)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定某补血剂中铁元素的含量。实验步骤如下: 请回答下列问题: (1)步骤②中加入足量NaOH发生的主要反应的离子方程式为 , 步骤③中反应的化学方程式为 。 (2)步骤④中一系列处理的操作步骤: 、洗涤、 、冷却、称量。 (3)若实验中需用98%的浓硫酸(密度为1.84g/mL)配制1 mol/L的稀硫酸480 mL。配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有 ,需用量筒量取该浓硫酸 mL。 (4)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。 |
|
最近更新



