湖南高三化学高考模拟(2019年下半期)带答案与解析
| 1. | 详细信息 | ||||||||||||||||||||
纵观古今,化学与生产生活密切相关。下列对文献的描述内容分析错误的是( )
|
|||||||||||||||||||||
| 2. | 详细信息 |
|
对甲基苯乙烯( A. 分子式为 B. 能发生加聚反应和氧化反应 C. 具有相同官能团的芳香烃同分异构体有5种 D. 分子中所有原子可能处于同一平面 |
|
| 3. | 详细信息 |
|
化学是一门以实验为基础的学科。下列实验装置和方案能达到相应目的是( ) A. 图装置  ,加热蒸发碘水提取碘 ,加热蒸发碘水提取碘B. 图装置  ,加热分解制得无水Mg ,加热分解制得无水MgC. 图装置  ,验证氨气极易溶于水 ,验证氨气极易溶于水D. 图装置  ,比较镁、铝的金属性强弱 ,比较镁、铝的金属性强弱 |
|
| 4. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A. B. 常温下, C. 13g由 D. |
|
| 5. | 详细信息 |
|
原子序数依次增大的四种短周期元素W、X、Y、Z,其中只有X与Z同主族;W、X、Y最外层电子数之和为10;Y是地壳中含量最高的金属元素。下列关于它们的叙述一定正确的是( ) A. Z的最高价氧化物对应的水化物为强酸 B. W、Y的氧化物一定属于离子化合物 C. X、Z的氢化物中,前者的沸点低于后者 D. X、Y的简单离子中,前者的半径大于后者 |
|
| 6. | 详细信息 |
如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( ) A. 若加人的是 B. 镍电极上的电极反应式为: C. 电子由石墨电极流出,经溶液流向镍电极 D. 若阳极生成 |
|
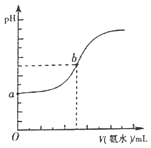
| 7. | 详细信息 |
已知室温下溶度积常数:Ksp[Pb(OH)2]=2×10-15,Ksp[Fe(OH)2]=8×10-15。当溶液中金属离子浓度小于10-5mol•L-1视为沉淀完全。向20mL含0.10mol•L-1Ph2+和0.10mol•L-1Fe2+的混合溶液中滴加010amol•L-1NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示,则下列说法正确的是( ) A. 曲线A表示 B. 当溶液 C. 滴入NaOH溶液体积大于30mL时,溶液中 D. 室温下,滴加NaOH溶液过程中,  比值不断增大 比值不断增大 |
|
| 8. | 详细信息 |
|
金属磷化物(如璘化锌)是常用的蒸杀虫剂。我国卫生部门规定:粮食中化物(以PH3计)的含量不超过0.050mg:kg-1时,粮食质量方达标。现设计测定粮食中残留磷化物含量的实验如下 (资料查阅)磷化锌易水解产生PH3;PH3沸点为-88℃,有剧毒性、强还原性、易自然。  (用量标准]如图:装置A、B、E中盛有的试剂均足量;C中装有100原粮;D中盛有40.00mL6.0×10-5 mol・L-1KMnO4溶液(H2SO4酸化)。 (操作流程)安装仪器并检査气密性→PH、的产生与吸收一转移KMnO4吸收溶液→用Na2SO3标准溶液滴定。 试回答下列问题: (1)仪器E的名称是______;仪器B、D中进气管下端设计成多孔球泡形状,目的是______。 (2)A装置的作用是______;B装置的作用是吸收空气中的O2,防止______。 (3)下列操作中,不利于精确測定出实验结果的是______(选填序号)。 a.实验前,将C中原粮预先磨碎成粉末 b.将蒸馏水预先煮沸、迅速冷却并注入E中 c.实验过程中,用抽气泵尽可能加快抽气速率 (4)弹化锌发生水解反应时除产生PH3外,还生成______(填化学式)。 (5)D中PH3被氧化成H3PO4,该反应的离子方程式为______。 (6)把D中吸收液转移至容量瓶中,加水稀释至250.00mL,取25.00mL于锥形瓶中,用 5.0×10-5mol・L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液10.00mL.则该原粮中磷化物(以PH3计)的含量为______mg・kg-1,该原粮质量______(填“达标”或“不达标“)。 |
|
| 9. | 详细信息 |
铈Ce)是一种重要的稀土金属元素,常见化合价为+3和+4,在工业上应用广泛。某课题组以回收废旧的电脑显示屏的玻璃粉(含SiO2、CeO2、Fe2O3、和FeO等)为原料,设如下工艺流程回收CeO2,并获得硫酸铁铵晶体[Fe2(SO4)3•2(NH4)2SO4•3H2O]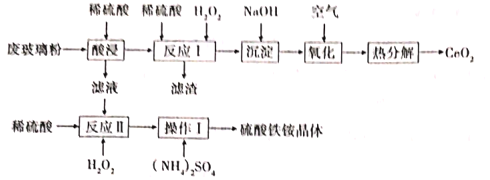 已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液;②酸浸时CeO2不反应;③“反应I”所得溶液中含有Ce3+。 试回答下列问题 (1)“滤渣”的化学式为______。 (2)在酸性条件下,H2O2、Fe3+、CeO2三种物质中,氧化性最强的是______;如将稀硫酸改为盐酸,则“酸浸”过程可能产生的大气污染物是______。 (3)“反应Ⅰ”的离子方程式为______。 (4)“氧化”反应的化学方程式为______。 (5)“操作Ⅰ”依次为:低温蒸发结晶、过滤、______常温晾干等操作。所得硫酸铁铵常用作净水剂,在去除酸性废水中的悬浮物时效率降低,原因是______。 (6)科学家利用CeO2在太阳能作用下将H2O、CO2转化成H2、CO,其过程如下:mCeO2 (m-x)CeO2•xCe+xH2O+xCO |
|
| 10. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||
|
有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题 (1)COS的分子结构与CO2相似,COS的结构式为______。 (2)已知:①COS(g)+H2(g)⇌H2S(g)+CO(g)△H1=-15kJ•mol-1,②COS(g)+H2(g)⇌H2S(g)+CO2(g)△H2=-36kJ•mol-1,③CO(g)+H2O(g)⇌H2(g)+CO2(g)△H3,则△H=______。 (3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)⇌COS(g)+H2(g),数据如表所示、据此填空
|
|||||||||||||||||||||||||||||||||||||||||||
| 11. | 详细信息 |
|
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题: (1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。 (2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。 (3)丁二酮肟( (4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:  ①A的熔、沸点高于B的原因为______。 ②B晶体含有化学键的类型为______(填选项字母)。 A.σ键 B.金属键 C.配位键 D.π键 (5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。 (6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。  |
|
| 12. | 详细信息 |
R・L・Claisen双酯缩合反应的机理如下:2RCH2COOC2H5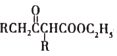 +C2H5OH,利用该反应制备化合物K的一种合成路线如图 +C2H5OH,利用该反应制备化合物K的一种合成路线如图 试回答下列问题: (1)A与氢气加成所得芳香烃的名称为______;A→B的反应类型是______;D中含氧官能团的名称是______。 (2)C的结构简式为______;F→G的反应除生成G外,另生成的物质为______。 (3)H→K反应的化学方程式为______。 (4)含有苯环结构的B的同分异构体有______种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为______(任写一种即可)。 (5)乙酰乙酸乙酯( 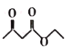 )是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。 )是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。 |
|