福建高二化学2019年下册月考测验网上考试练习
| 1. 选择题 | 详细信息 |
|
心脏搏动产生电流传导到体表,使体表不同部位产生电位差。做心电图时在仪器与病人皮肤接触部位应该擦( ) A. 医用酒精 B. 氯化钠溶液 C. 葡萄糖溶液 D. 碘酒 |
|
| 2. 选择题 | 详细信息 |
|
某学生提供的实验数据如下,其中肯定错误的是( ) ①用100毫升的量筒量取67.60mL的液体 ②用托盘天平称取22.5gKCl ③酸碱中和滴定时,消耗0.1000 mol/L的盐酸23.25 mL ④用广泛pH试纸测得某溶液的pH=4.4 A. ①② B. ②③ C. ③④ D. ①④ |
|
| 3. 选择题 | 详细信息 |
|
等浓度的下列稀溶液:①乙酸Ka:1.76×10—5、②HClO Ka:2.95×10—8、③碳酸Ka1:4.30×10—7、④乙醇,它们的pH由小到大排列正确的是( ) A. ④②③① B. ③①②④ C. ①②③④ D. ①③②④ |
|
| 4. 选择题 | 详细信息 |
|
已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H =-55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于 A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol |
|
| 5. 选择题 | 详细信息 |
|
在容积可变的密闭容器中,2mo1N2和8mo1H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于 A. 5% B. 10% C. 15% D. 20% |
|
| 6. 选择题 | 详细信息 |
|
已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是 A. 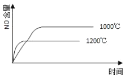 B. 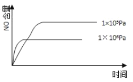 C.  D.  |
|
| 7. 选择题 | 详细信息 |
|
电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( ) A. 0.10mol/LAg+ B. 0.20mol/LZn2+ C. 0.20mol/LCu2+ D. 0.20mol/LPb2+ |
|
| 8. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b B. 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7 C. 常温下,1.0×10—3mol/L盐酸的pH=3.0,1.0×10—8mol/L盐酸pH=8.0 D. 常温下,若1mLpH=1盐酸与100mLNaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11 |
|
| 9. 选择题 | 详细信息 |
根据下图,可判断出下列离子方程式中错误的是  A. B. C. D. |
|
| 10. 选择题 | 详细信息 |
右图表示反应X(g) 下列有关该反应的描述正确的是( ) A. 第6min后,反应就终止了 B. X的平衡转化率为85% C. 若升高温度,X的平衡转化率将大于85% D. 若降低温度,v正和v逆将以同样倍数减小 |
|
| 11. 选择题 | 详细信息 |
|
用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是 A.c(NH4+)>c(Cl-),c(OH-)>c(H+) B.c(NH4+)=c(Cl-),c(OH-)=c(H+) C.c(Cl-)> c(NH4+), c(OH-)>c(H+) D.c(Cl-)> c(NH4+),c(H+)> c(OH-) |
|
| 12. 选择题 | 详细信息 |
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是( )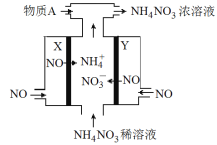 A. 物质A为NH3 B. X电极为电解池阳极 C. Y电极上发生了还原反应 D. Y电极反应式为:NO-3e-+4OH-==NO3-+2H2O |
|
| 13. 选择题 | 详细信息 |
下列图示与对应的叙述相符的是( ) A. 图甲表示催化剂能改变化学反应的焓变 B. 图乙表示向氨水中加水时溶液导电性的变化情况,且溶液c(OH—)大小:a<b C. 由图丙可知反应2A(g)+B(g) D. 图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化情况 |
|
| 14. 选择题 | 详细信息 |
|
常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( ) A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③ B. 往稀氨水中加水, C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—) D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强 |
|
| 15. 选择题 | 详细信息 |
常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( ) A. NaHB溶液可能为酸性,也可能为碱性 B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大 C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+) D. F点溶液c(NH4+)=2c(B2-) |
|
| 16. 选择题 | 详细信息 |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图,下列说法正确的是( ) A. 283 K时,图中a点对应的溶液是不饱和溶液 B. 三个不同温度下,363 K时Ksp(SrSO4)最大 C. 温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小 D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
|
| 17. 综合题 | 详细信息 |
|
已知K、Ka、Kb、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、弱碱的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。 (1)有关上述常数的说法正确的是______。 a.它们都能反映一定条件下对应变化进行的程度 b.它们的大小都随温度的升高而增大 c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh (2)25℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=____。 (3)高炉炼铁中发生的反应有FeO(s)+CO(g) (4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是______(已知lg2=0.3)。 |
|
| 18. 实验题 | 详细信息 | ||||||||||
|
某学生用邻苯二甲酸氢钾,(分子式为 (1)写出邻苯二甲酸氢钾与NaOH反应的化学方程式:________。 (2)将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂_____(从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是________。 (3)该实验要用到的主要玻璃仪器_______、______。 (4)该学生进行三次实验,所取固体的质量均相同,填写下表:
|
|||||||||||
| 19. 填空题 | 详细信息 |
|
(1)CO还原脱硝技术可有效降低烟气中的NOx的排放量。回答下列问题: CO还原NO的脱硝反应:2CO(g)+2NO(g)⇌2CO2(g)+N2(g) △H 已知:CO(g)+NO2(g)⇌CO2(g)+NO(g) △H1=—226kJ•mol—1 N2(g)+2O2(g)⇌2NO2(g) △H2=+68kJ•mol—1 N2(g)+O2(g)⇌2NO(g) △H3=+183kJ•mol—1 脱硝反应△H=______,该反应向正反应方向自发进行的倾向很大,其原因是_______,有利于提高NO平衡转化率的条件是(写出两条)________、___________。 (2)直接供氨式燃料电池是以NaOH溶液为电解质的.电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为_________。 (3)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出阳极的电极反应式_______。  |
|
| 20. 填空题 | 详细信息 |
|
在含有弱电解质的溶液中,往往有多个化学平衡共存。 (1)一定温度下,向1L0.1mol•L﹣1CH3COOH溶液中加入0.1molCH3COONa固体,平衡后则溶液中 (2)常温下向20mL 0.1mol•L﹣1Na2CO3溶液中逐滴加入0.1mol•L﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:  回答下列问题: ①在同一溶液中,H2CO3、HCO3﹣、CO32﹣___(填“能”或“不能”)大量共存; ②当pH=7时,溶液中含碳元素的主要微粒有_____、___,溶液中含量最多的三种微粒的物质的量浓度的大小关系为____; ③已知在25℃时,CO32﹣水解反应的平衡常数即水解常数Kh═2×10﹣4 mol•L﹣1,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,溶液的pH=_____。 |
|
最近更新



