2019е№ҙй«ҳдәҢеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲдёҠжө·еёӮжқЁжөҰй«ҳзә§пјү
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жңүе…іеҗҲйҮ‘зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү A. з”ҹй“ҒжҜ”зәҜй“ҒзҶ”зӮ№й«ҳ B. й’ўжҜ”зәҜй“ҒзЎ¬ C. еҗҲйҮ‘дёҚе…·жңүеҜјзғӯжҖ§ D. еҗҲйҮ‘йғҪдёҚеҗ«йқһйҮ‘еұһе…ғзҙ |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ еҢ–еӯҰжҖ§иҙЁеҸ‘з”ҹе‘ЁжңҹеҸҳеҢ–жҖ§иҙЁеҸҳеҢ–зҡ„ж №жң¬еҺҹеӣ жҳҜ A.е…ғзҙ зҡ„еҺҹеӯҗеҚҠеҫ„е‘Ҳе‘ЁжңҹжҖ§зҡ„еҸҳеҢ– B.е…ғзҙ зҡ„еҢ–еҗҲд»·е‘ҲзҺ°е‘ЁжңҹжҖ§еҸҳеҢ– C.е…ғзҙ еҺҹеӯҗж ёеӨ–з”өеӯҗжҺ’еёғе‘ҲзҺ°е‘ЁжңҹжҖ§еҸҳеҢ– D.е…ғзҙ зҡ„йҮ‘еұһжҖ§е’ҢйқһйҮ‘еұһжҖ§е‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ– |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘дёҖе°Ҹзғ§жқҜдёӯеҲҶеҲ«еҠ е…ҘзӯүдҪ“з§Ҝзҡ„ж°ҙе’Ңз…ӨжІ№пјҢзүҮеҲ»еҗҺеҶҚеҗ‘иҜҘзғ§жқҜдёӯзј“ж…ўең°еҠ е…ҘдёҖз»ҝиұҶзІ’еӨ§зҡ„йҮ‘еұһй’ пјҢеҸҜиғҪи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜдёӢеӣҫдёӯзҡ„(гҖҖгҖҖ) A.  B. B. 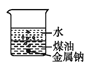 C. C.  D. D.  |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжқЎд»¶дёӢпјҢдёӢеҲ—йҮ‘еұһдёӯиғҪдёҺж°ҙеҸ‘з”ҹзҪ®жҚўеҸҚеә”并дә§з”ҹйҮ‘еұһж°§еҢ–зү©зҡ„жҳҜ A.й“қ B.й•Ғ C.й“Ғ D.й’ |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡиҙЁйҮҸзҡ„й“қзүҮеҲҶеҲ«е’ҢзӣёеҗҢжө“еәҰгҖҒзӣёеҗҢдҪ“з§Ҝж°ўж°§еҢ–й’ жә¶ж¶Іе’Ңзӣҗй…ёеҸҚеә”пјҢж”ҫеҮәж°ўж°”зҡ„иҙЁйҮҸ A.дёҖж ·еӨҡ B.е’Ңзӣҗй…ёеҸҚеә”ж”ҫеҮәзҡ„еӨҡ C.е’Ңж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”ж”ҫеҮәзҡ„еӨҡ D.дёҚиғҪзЎ®е®ҡ |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁзҡ„жЈҖйӘҢж–№жі•дёӯпјҢжІЎжңүеҸ‘з”ҹйўңиүІеҸҳеҢ–зҡ„жҳҜ A. з”Ёж№ҝж¶Ұзҡ„ж·ҖзІүвҖ“KIиҜ•зәёжЈҖйӘҢж°Ҝж°” B. з”Ёж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёжЈҖйӘҢж°Ёж°” C. з”ЁKSCNжә¶ж¶ІжЈҖйӘҢж°ҜеҢ–й“Ғдёӯзҡ„Fe3+ D. з”Ёзӣҗй…ёжЈҖйӘҢзўій…ёй’ дёӯзҡ„CO32вҖ“ |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёҺж°Ёзўұжі•зӣёжҜ”иҫғпјҢиҒ”еҗҲеҲ¶зўұжі•жңҖзӘҒеҮәзҡ„дјҳзӮ№жҳҜ A. и®ҫеӨҮе°‘ B. еҺҹж–ҷжҳ“еҫ— C. еҫӘзҺҜеҲ©з”Ёзҡ„зү©иҙЁеӨҡ D. NaClеҲ©з”ЁзҺҮй«ҳ |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ізү©иҙЁжҖ§иҙЁзҡ„жҜ”иҫғпјҢй”ҷиҜҜзҡ„жҳҜ A.йҮ‘еұһжҖ§пјҡMgпјһAl B.зЁіе®ҡжҖ§пјҡHFпјһHCl C.зўұжҖ§пјҡNaOHпјһMg(OH)2 D.й…ёжҖ§пјҡH2SO4пјһHClO4 |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
еҢ–еӯҰеңЁз”ҹжҙ»дёӯжңүзқҖе№ҝжіӣзҡ„еә”з”ЁпјҢдёӢеҲ—еҜ№еә”е…ізі»й”ҷиҜҜзҡ„жҳҜ
|
||||||||||||||||
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁж°ҙдёӯеҠ е…ҘдёӢеҲ—зү©иҙЁеҗҺпјҢжҠ‘еҲ¶ж°ҙзҡ„з”өзҰ»зҡ„жҳҜ A.Na2CO3 B.NaOH C.FeCl3 D.Na |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁpHдёә1зҡ„100mL0.1mol/Lзҡ„AlCl3дёӯпјҢеҠ е…Ҙ300mL0.1mol/Lзҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІеҗҺй“қе…ғзҙ зҡ„еӯҳеңЁеҪўејҸжҳҜпјҲ пјү A.AlO2- B.Al3+ C.Al(OH)3 D.Al3+гҖҒAl(OH)3 |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—ж—ўиғҪе’Ңзӣҗй…ёеҸҚеә”пјҢеҸҲиғҪе’Ңзғ§зўұжә¶ж¶ІеҸҚеә”зҡ„зү©иҙЁжҳҜ в‘ NaHCO3 в‘Ў(NH4)2CO3 в‘ўAl в‘ЈAl2O3 в‘ӨAl(OH)3 A.в‘ в‘Ўв‘ўв‘Јв‘Ө B.в‘ в‘ўв‘Јв‘Ө C.в‘ в‘ўв‘Ј D.в‘ в‘ўв‘Јв‘Ө |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ A.еҗ‘зӣҗй…ёдёӯеҠ е…Ҙй“ҒзІүпјҡ2Fe +6H+ вҶ’2Fe3пјӢ + 3H2вҶ‘ B.еҗ‘FeCl3жә¶ж¶ІдёӯйҖҡе…ҘH2Sж°”дҪ“пјҡFe3+ + H2S вҶ’FeS вҶ“ + 2H+ C.еҗ‘Al(OH)3 дёӯеҠ е…ҘNaOHжә¶ж¶І пјҡAl(OH)3 + OHп№Ј вҶ’ AlO2-+ 2H2O D.еҗ‘NaAlO2жә¶ж¶ІдёӯйҖҡе…ҘиҝҮйҮҸCO2пјҡAlO2п№Ј+ CO2+ H2O вҶ’ Al(OH)3 вҶ“ +HCO3п№Ј |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёҺAlеҸҚеә”ж”ҫеҮәеӨ§йҮҸж°ўж°”зҡ„жә¶ж¶ІдёӯпјҢдёӢеҲ—зҰ»еӯҗеҸҜиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ A.Mg2+гҖҒNa+гҖҒCl-гҖҒNO3- B.K+гҖҒNa+гҖҒCl-гҖҒHCO3- C.Na+гҖҒNH4+гҖҒCl-гҖҒCH3COO- D.Fe2+гҖҒBa2+гҖҒCl-гҖҒI- |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„жә¶ж¶Ідёӯзҡ„еҸҚеә”пјҢдёҚи®әеҸҚеә”зү©йҮҸзҡ„еӨҡе°‘пјҢйғҪеҸӘиғҪз”ЁеҗҢдёҖдёӘзҰ»еӯҗж–№зЁӢејҸжқҘиЎЁзӨәзҡ„жҳҜ A.FeBr2дёҺCl2 B.Ba(OH)2дёҺCO2 C.HClдёҺNa2CO3 D.AlCl3дёҺж°Ёж°ҙ |
|
| 16. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғж—¶пјҢжө“еәҰзӣёеҗҢзҡ„Na2CO3е’ҢNaHCO3жә¶ж¶ІпјҢдёӢеҲ—еҲӨж–ӯй”ҷиҜҜзҡ„жҳҜпјҲгҖҖгҖҖпјү A.зІ’еӯҗз§Қзұ»дёҚеҗҢ B.c(Na+)еүҚиҖ…еӨ§дәҺеҗҺиҖ… C.c(OH-)еүҚиҖ…еӨ§дәҺеҗҺиҖ… D.еҲҶеҲ«еҠ е…ҘNaOHеӣәдҪ“пјҢc(CO32-)еқҮеўһеӨ§ |
|
| 17. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
дёӢеҲ—йҷӨеҺ»жқӮиҙЁзҡ„ж–№жі•й”ҷиҜҜзҡ„жҳҜ
|
|||||||||||||||||||||
| 18. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
е…ідәҺдёӢеҲ—иЈ…зҪ®пјҢеҸҷиҝ°й”ҷиҜҜзҡ„жҳҜпјҲ пјү A.зҹіеўЁз”өжһҒеҸҚеә”O2+4H++4eвҶ’2H2O B.йј“е…Ҙе°‘йҮҸз©әж°”пјҢдјҡеҠ еҝ«Feзҡ„и…җиҡҖ C.еҠ е…Ҙе°‘йҮҸNaClпјҢдјҡеҠ еҝ«Feзҡ„и…җиҡҖ D.еҠ е…ҘHClпјҢзҹіеўЁз”өжһҒеҸҚеә”ејҸпјҡ2H++2eвҶ’H2 |
|
| 19. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
дёӢеҲ—AгҖҒBдёӨзү©иҙЁеҸҚеә”ж—¶пјҢиҪ¬з§»зҡ„з”өеӯҗзҡ„зү©зҗҶйҮҸжӯЈзЎ®зҡ„жҳҜ(NAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°)
|
|||||||||||||||||||||
| 20. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
дёӢеӣҫжҳҜе·ҘдёҡеҲ¶зәҜзўұзҡ„йғЁеҲҶзү©иҙЁиҪ¬еҢ–зӨәж„ҸеӣҫпјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A. XжҳҜNH3пјҢYжҳҜCO2 B. MеҸҜеңЁиҪ¬еҢ–жөҒзЁӢдёӯеҫӘзҺҜеҲ©з”Ё C. иӢҘжҳҜиҒ”еҗҲеҲ¶зўұжі•пјҢеҲҷLзҡ„дё»иҰҒжҲҗеҲҶжҳҜNH4Cl D. иӢҘжҳҜж°Ёзўұжі•пјҢжә¶ж¶ІcеҸҜеңЁиҪ¬еҢ–жөҒзЁӢдёӯеҫӘзҺҜеҲ©з”Ё |
|
| 21. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
Fe2(SO4)3жә¶ж¶ІеҸҜйҷӨеҺ»з…Өдёӯд»Ҙй»„й“ҒзҹҝпјҲFeS2пјүеҪўејҸеӯҳеңЁзҡ„зЎ«е…ғзҙ пјҢеҸҚеә”еҰӮдёӢпјҡ ______FeS2 + ______Fe2(SO4)3 +______H2O вҶ’______FeSO4 + ______H2SO4 пјҲ1пјүиҜ•й…Қе№іеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҢ并用еҚ•зәҝжЎҘж ҮеҮәз”өеӯҗиҪ¬з§»ж–№еҗ‘еҸҠж•°зӣ®_____пјӣиҝҳеҺҹеүӮжҳҜ_______пјҢиҝҳеҺҹдә§зү©жҳҜ_________пјҢиў«иҝҳеҺҹзҡ„е…ғзҙ жҳҜ__________гҖӮ пјҲ2пјүFe2(SO4)3жә¶ж¶Іе‘Ҳ_____жҖ§пјҢз”ЁзҰ»еӯҗж–№зЁӢејҸи§ЈйҮҠе…¶еҺҹеӣ ________гҖӮ пјҲ3пјүжЈҖйӘҢдёҠиҝ°еҸҚеә”дёӯFe2(SO4)3жҳҜеҗҰж¶ҲиҖ—е®Ңзҡ„е®һйӘҢж–№жЎҲпјҡ_________________________гҖӮ пјҲ4пјүиҜҘж–№жі•зҡ„дјҳзӮ№д№ӢдёҖжҳҜFe2(SO4)3жҳ“еҶҚз”ҹгҖӮеҗ‘еҸҚеә”еҗҺзҡ„жә¶ж¶ІдёӯйҖҡе…Ҙ__________пјҢе°ұиғҪиҫҫеҲ°дҪҝFe2(SO4)3еҶҚз”ҹзҡ„зӣ®зҡ„пјҢж–№дҫҝдё”д»·е»үгҖӮ пјҲ5пјүе®һйӘҢе®Ө.й…ҚеҲ¶дёҖе®ҡйҮҸFeSO4жә¶ж¶Іж—¶пјҢйңҖеҠ е…Ҙе°‘йҮҸ_____е’Ң_______е…¶зӣ®зҡ„жҳҜ_______гҖӮ |
|
| 22. жҺЁж–ӯйўҳ | иҜҰз»ҶдҝЎжҒҜ |
ж··еҗҲзү©Aеҗ«жңүKAl(SO4)2гҖҒAl2O3е’ҢFe2O3пјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҰӮеӣҫжүҖзӨәзҡ„зү©иҙЁд№Ӣй—ҙзҡ„еҸҳеҢ–пјҡ пјҲ1пјүеӣәдҪ“Dзҡ„еҢ–еӯҰејҸдёә___________ пјҲ2пјүеҶҷеҮәеҸҚеә”в‘ гҖҒв‘Јзҡ„зҰ»еӯҗж–№зЁӢејҸ________________гҖҒ_____________ пјҲ3пјүжә¶ж¶ІCдёӯеҗ«жңүзҡ„дё»иҰҒзҰ»еӯҗжҳҜ______________________ пјҲ4пјүж“ҚдҪңв‘ӨжҳҜ__________гҖҒ______________________ пјҲ5пјүеҰӮеӣҫиЎЁзӨәAlCl3дёҺNaOHжә¶ж¶Ізӣёдә’ж»ҙеҠ зҡ„дёӨз»„е®һйӘҢиҝҮзЁӢдёӯпјҢеҫ®зІ’ж•°йҮҸзҡ„е…ізі»жӣІзәҝгҖӮеҲӨж–ӯдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ_____________  AпјҺAзәҝеҸҜиЎЁзӨәAl3пјӢжҲ–OHвҖ”зҡ„зү©иҙЁзҡ„йҮҸзҡ„еҸҳеҢ– BпјҺB C DзәҝеқҮеҸҜиЎЁзӨәAlO2вҖ”зҡ„зү©иҙЁзҡ„йҮҸзҡ„еҸҳеҢ– CпјҺB C DзәҝеқҮеҸҜиЎЁзӨәAl(OH)3зҡ„зү©иҙЁзҡ„йҮҸзҡ„еҸҳеҢ– DпјҺеҗҢдёҖз»„е®һйӘҢдёӯAгҖҒBгҖҒCгҖҒDзәҝдёҚеҸҜиғҪе…ЁйғЁеҮәзҺ° |
|
| 23. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
дёӢиЎЁжҳҜе…ғзҙ е‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶпјҡпјҲдёҚеҫ—з”Ёa~hеӯ—жҜҚеӣһзӯ”пјүе…ғзҙ е‘ЁжңҹиЎЁжңү7дёӘжЁӘиЎҢпјҢжҜҸдёҖдёӘжЁӘиЎҢз§°дёәвҖңе‘ЁжңҹвҖқпјҢе‘ЁжңҹеәҸж•°=з”өеӯҗеұӮж•°пјӣе…ғзҙ е‘ЁжңҹиЎЁе…ұжңү18еҲ—пјҢжҜҸдёҖеҲ—з§°дёә вҖңж—ҸвҖқпјҢдёӢиЎЁдёӯзҡ„7еҲ—дёәдё»ж—Ҹе…ғзҙ пјҢеҲҶеҲ«з”ЁзҪ—马数еӯ—в… гҖҒв…ЎгҖҒвҖҰвҖҰиЎЁжҳҺж—ҸеәҸж•°пјҢж—ҸеәҸж•°=жңҖеӨ–еұӮз”өеӯҗж•°гҖӮ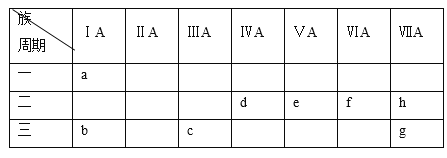 ж №жҚ®aпҪһhеҗ„е…ғзҙ зҡ„жҖ§иҙЁпјҢйҖүжӢ©зӣёеә”зҡ„еҢ–еӯҰз¬ҰеҸ·гҖҒеҢ–еӯҰејҸжҲ–еҢ–еӯҰж–№зЁӢејҸеЎ«з©әпјҡ пјҲ1пјүеҚ•иҙЁж°§еҢ–жҖ§жңҖејәзҡ„жҳҜ__________пјҢй…ёжҖ§жңҖејәзҡ„еҗ«ж°§й…ёжҳҜ_____________гҖӮ пјҲ2пјүеҶҷеҮәeзҡ„зўұжҖ§ж°”жҖҒж°ўеҢ–зү©зҡ„з”өеӯҗејҸ_____пјҢе°Ҷе®ғе’ҢеҢ–еҗҲзү©df 2йҖҡе…ҘйҘұе’ҢйЈҹзӣҗж°ҙеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ_____гҖӮ пјҲ3пјүжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӯпјҢзўұжҖ§жңҖејәзҡ„жҳҜ___________гҖӮ пјҲ4пјүеңЁbгҖҒcгҖҒgгҖҒhдёӯпјҢеёёи§ҒзҰ»еӯҗеҚҠеҫ„жңҖеӨ§зҡ„жҳҜ__________гҖӮ |
|
| 24. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
еҗ‘жө“еәҰзӣёзӯүгҖҒдҪ“з§ҜеқҮдёә100 mLзҡ„AгҖҒBдёӨд»ҪNaOHжә¶ж¶ІдёӯпјҢеҲҶеҲ«йҖҡе…ҘдёҖе®ҡйҮҸзҡ„CO2еҗҺпјҢйҖҗж»ҙеҠ е…Ҙ0.1 mol/Lзҡ„зӣҗй…ёпјҢдә§з”ҹCO2зҡ„дҪ“з§Ҝ(ж ҮеҮҶзҠ¶еҶө)дёҺжүҖеҠ зӣҗй…ёзҡ„дҪ“з§Ҝе…ізі»еҰӮеӣҫжүҖзӨәгҖӮ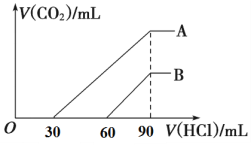 пјҲ1пјүAжӣІзәҝиЎЁжҳҺпјҢеҺҹжә¶ж¶ІйҖҡе…ҘCO2 ________mL(ж ҮеҮҶзҠ¶еҶө)гҖӮ пјҲ2пјүBжӣІзәҝиЎЁжҳҺпјҢеҺҹжә¶ж¶ІйҖҡе…ҘCO2еҗҺпјҢжүҖеҫ—жә¶ж¶Ідёӯжә¶иҙЁзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә__________гҖӮ пјҲ3пјүеҺҹNaOHжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә__________гҖӮ |
|
й«ҳдёӯеҢ–еӯҰ иҜ•еҚ·жҺЁиҚҗ
- еҢ—дә¬еёӮй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•йўҳе…Қиҙ№иҜ•еҚ·
- 2019-2020е№ҙй«ҳдёҖдёӢеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰдё“йўҳи®ӯз»ғпјҲз”ҳиӮғзңҒеј жҺ–еёӮй«ҳеҸ°еҺҝ第дёҖдёӯеӯҰпјү
- еӨҜеҹәжҸҗиғҪй«ҳдёүеҢ–еӯҰдёӢеҶҢдё“йўҳз»ғд№ иҜ•еҚ·е®Ңж•ҙзүҲ
- й«ҳдёүеҢ–еӯҰдёӢеҶҢдё“йўҳз»ғд№ иҖғиҜ•е®Ңж•ҙзүҲ
- еұұдёң2019е№ҙй«ҳдёҖеҢ–еӯҰдёӢеӯҰжңҹжңҲиҖғжөӢйӘҢиҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- 2018е№ҙиҮі2019е№ҙй«ҳдёҖдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲжІіеҢ—зңҒиҫӣйӣҶдёӯеӯҰпјү
- 2018иҮі2019е№ҙй«ҳдёҖдёӢжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•еҚ·пјҲй»‘йҫҷжұҹзңҒеҸҢйёӯеұұеёӮ第дёҖдёӯеӯҰпјү
- з»өйҳіеҚ—еұұдёӯеӯҰй«ҳдёүеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёӢжңҹпјүеҗҢжӯҘз»ғд№
жңҖиҝ‘жӣҙж–°



