镇雄县民族中学高一化学上册期末考试免费试卷完整版
| 1. 选择题 | 详细信息 |
|
下列有关叙述正确的是( ) A. 电泳现象可证明胶体带电荷 B. 直径在1~100 nm之间的粒子称为胶体 C. 是否具有丁达尔效应是溶液和胶体的本质区别 D. 胶体粒子很小,可以透过滤纸 |
|
| 2. 选择题 | 详细信息 |
|
氧化钠为碱性氧化物,二氧化硫是酸性氧化物,根据其类别推测二氧化硫不具有的性质是 ( ) A. 与氧化钠反应生成亚硫酸钠 B. 与足量的氢氧化钾反应生成亚硫酸钾和水 C. 与盐酸反应 D. 与足量的石灰水反应生成亚硫酸钙和水 |
|
| 3. 选择题 | 详细信息 |
|
下列说法正确的是 ( ) A. SO2的摩尔质量为64 g B. 气体的摩尔体积约为22.4 L·mol-1 C. 12 g12C中所含碳原子数即为阿伏加德罗常数 D. 4 g NaOH溶于1 L水所得溶液的物质的量浓度为0.1 mol·L-1 |
|
| 4. 选择题 | 详细信息 |
|
在水泥厂、冶金厂常用高压电作用于气溶胶,以除去大量烟尘,减少烟尘对空气的污染。这种除尘法的原理是( ) A.渗析 B.电泳 C.聚沉 D.丁达尔效应 |
|
| 5. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 硫酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 B. 6.02×1023个N2和6.02×1023个O2的质量比等于7∶8 C. 3.2 g O2所含的原子数目约为0.2×6.02×1023 D. 常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44 g |
|
| 6. 选择题 | 详细信息 |
|
在下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓来表示的是( ) A.BaCl2+Na2SO4=BaSO4↓+2NaCl B.Ba(OH)2+H2SO4=BaSO4↓+2H2O C.BaCl2+H2SO4=BaSO4↓+2HCl D.Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 |
|
| 7. 选择题 | 详细信息 |
|
在溶液中能大量共存的离子组是( ) A.Ag+ Cl- Na+ B.H+ OH- K+ C.K+ |
|
| 8. 选择题 | 详细信息 |
|
一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后再溶于水可得Z溶液,Y和Z反应又生成X,则X是( ) A.硫酸铵 B.硝酸铵 C.氯化铵 D.碳酸氢铵 |
|
| 9. 选择题 | 详细信息 |
|
下列气体中,无色有毒、能污染大气,能用碱液吸收的是( ) A. 一氧化碳 B. 二氧化碳 C. 二氧化硫 D. 氯气 |
|
| 10. 选择题 | 详细信息 |
|
下列叙述正确的是 A. 1 mol任何气体的体积都为22.4 L B. 1 mol任何物质在标准状况下所占的体积都为22.4 L C. 只有在标准状况下,气体摩尔体积才约为22.4 L·mol-1 D. 标准状况下,22.4 L任何气体的物质的量都是1 mol |
|
| 11. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数,下列说法中正确的是( ) A. 18 g H2O所含的分子数为NA B. 22.4 L H2O所含的分子数为NA C. NA个氢原子的质量为2 g D. 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl﹣ |
|
| 12. 选择题 | 详细信息 |
|
下列各组物质中氮元素的化合价由低到高的排列顺序是( ) A. N2、NH3、NO2 B. NH3、N2O5、NO2 C. N2、N2O3、NH3 D. NH3、N2、N2O3 |
|
| 13. 选择题 | 详细信息 |
|
三种都能与酸反应的金属混合物共2.3 g,与足量的稀盐酸反应,生成氢气0.1 g,则这三种金属可能是( ) A. Cu、Na、Al B. Zn、Na、Fe C. Mg、Na、Al D. Zn、Na、Al |
|
| 14. 选择题 | 详细信息 |
|
下列关于反应KClO3+6HCl=KCl+3Cl2↑+2H2O的说法不正确的是( ) A. KClO3是氧化剂 B. H2O既不是氧化产物也不是还原产物 C. HCl是还原剂 D. KCl既是还原产物也是氧化产物 |
|
| 15. 选择题 | 详细信息 |
|
若从水溶液中获取下列物质,可选用关于蒸发结晶的是( ) A.氯化氢 B.酒精 C.食盐 D.铜粉 |
|
| 16. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A. 向氢氧化钠溶液中通入少量的二氧化硫:SO2+OH-=HSO3- B. 向新制氯水中通入少量的二氧化硫:Cl2+SO2+2H2O=4H++2Cl-+SO42- C. 将二氧化硫通入饱和碳酸氢钠溶液:2H++CO32-=H2O+CO2↑ D. 将二氧化硫通入氯化钡溶液:SO2+H2O+Ba2+=BaSO3↓+2H+ |
|
| 17. 选择题 | 详细信息 |
|
关于硫酸铜的下列说法中不正确的是( ) A.无水硫酸铜是一种白色粉末 B.硫酸铜俗称蓝矾、胆矾 C.蓝矾的摩尔质量为250g·mol-1 D.实验室常用无水硫酸铜检验水的存在 |
|
| 18. 选择题 | 详细信息 |
|
下列关于硝酸性质的说法不正确的是( ) A. 硝酸能与水易任意比互溶 B. 质量分数足够大时可形成发烟硝酸 C. 不易挥发,有刺激性气味 D. 浓硝酸因分解生成的二氧化氮又溶于硝酸而呈黄色 |
|
| 19. 选择题 | 详细信息 |
|
下列关于分散系的说法不正确的是 A. 分散系的稳定性:溶液>胶体>浊液 B. 分散质粒子的大小:溶液>胶体>浊液 C. 分散质粒子的直径为几纳米或几十纳米的分散系是胶体 D. 可以用过滤的方法将悬浊液中的分散质从分散剂中分离出来 |
|
| 20. 选择题 | 详细信息 |
|
下列电离方程式书写正确的是( ) A.NaOH=Na++O2-+H+ B.FeCl3=Fe3++ C.Ca(NO3)2=Ca2++2(NO3)2- D.H2SO4=2H++ |
|
| 21. 选择题 | 详细信息 |
|
下列说法中正确的是 A. 氧化剂本身发生氧化反应 B. 氧化还原反应一定有氧元素参加 C. 氧化剂在反应中得电子,还原剂失去电子 D. 氧化反应一定先于还原反应发生 |
|
| 22. 选择题 | 详细信息 |
|
下列各组在溶液中的反应,不管反应物的量是多少,都能用同一离子方程式表示的是( ) A.NaOH与CO2 B.Ba(OH)2与H2SO4 C.HCl与Na2CO3 D.NaHSO4与Ba(OH)2 |
|
| 23. 选择题 | 详细信息 |
|
在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( ) A. 总反应为NO+NO2+O2+H2O===2HNO3 B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3 C. 生成硝酸的物质的量浓度均为0.030 mol·L-1 D. 生成硝酸的物质的量浓度约为0.060 mol·L-1 |
|
| 24. 选择题 | 详细信息 | ||||||||||||||||||||
查阅以下有关焊锡(锡和铅)和武德合金(铅、铋、锡、镉)组成的合金熔点数据,你能得出的结论是( )
|
|||||||||||||||||||||
| 25. 综合题 | 详细信息 | ||||||||
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。 (1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。 (2)试剂Y的名称为______________。 (3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。 ①提出合理假设。 假设1:存在两种成分:NaHCO3和____________________________; 假设2:存在三种成分:NaHCO3和__________________________。 ②设计方案,进行实验。写出实验步骤以及预期现象和结论。 限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
|
|||||||||
| 26. 推断题 | 详细信息 |
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)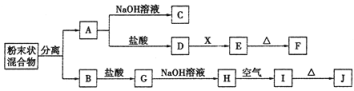 (1)写出下列物质的化学式:F____________,G________________。 (2)将混合物中两种金属分离开的最简单的方法是___________。 (3)D→E的转化中,加入过量的X可能是_____________________。 A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液 (4)写出下列转化的化学方程式: A→C:______________________________________________; H→I:_______________________________________________。 |
|
| 27. 推断题 | 详细信息 |
A~H为中学化学中常见的物质,转化关系如下图所示,其中“○”代表化合物,“□”代表单质,A为医学上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体。 请回答下列问题: (1)G的化学式为________,每生成1个G转移电子________个。 (2)反应①②③④中________(填序号)属于氧化还原反应。 (3)写出下列反应的化学方程式: A→B+C+D:___________________________________, F+C:__________________________________________。 |
|
| 28. 实验题 | 详细信息 |
|
工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。 工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:  (1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。 a.石灰石 b.锌粒 c.纯碱 (2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。 (3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________ . |
|
| 29. | 详细信息 |
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示: 据此流程图回答下列问题: (1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。 (2)②中Al2O3参与反应的离子方程式为__________。 (3)③中调节pH不能用CO2的理由是____________________。 (4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。 (5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。 (6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。 |
|
| 30. 推断题 | 详细信息 |
已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示: 请填写下列空白: (1)写出下列物质的化学式:B________,I________,J________。 (2) A的化学式是__________________。 (3)写出下列反应的离子方程式: ①H+E(溶液)→M_________________________________________________________。 ②I溶于G________________________________________________________________。 (4)写出反应①的化学方程式_________________________________________________。 |
|
最近更新



