攀枝花市2019年高一化学下学期期末考试免费检测试卷
| 1. 选择题 | 详细信息 |
|
以下能级符号不正确的是( ) A. 3s B. 3p C. 3d D. 3f |
|
| 2. 选择题 | 详细信息 |
|
根据下列电子排布式判断,处于激发态的原子是 A. 1s22s22p6 B. 1s22s22p63s1 C. 1s22s23s1 D. [Ar]3d14s2 |
|
| 3. 选择题 | 详细信息 |
|
人造的115号元素被我国命名为“镆”,取自我国古代宝剑之名“镆铘”。下列相关叙述正确的是 A. 镆元素的质量数为115 B. 镆铘剑中可能含有镆 C. 镆原子的中子数为115 D. 镆铘剑中一定不含镆 |
|
| 4. 选择题 | 详细信息 |
|
化学点亮生活。下列说法中,不正确的是 A. 沙子是基本的建筑材料 B. 光导纤维的主要成分是硅 C. 硅酸钠是制备木材防火剂的原料 D. 目前制作太阳能电池板的材料是硅 |
|
| 5. 选择题 | 详细信息 |
|
下列冶炼金属的反应原理,不正确的是 A. 铝热法炼铁:Fe2O3 + 2Al 高温Al2O3 + 2Fe B. 火法炼铜:Cu2S + O2 高温2Cu + SO2 C. 电解法制钠:2NaCl(熔融) 电解2Na + Cl2↑ D. 电解法制镁:2MgO(熔融) 电解2Mg + O2↑ |
|
| 6. 选择题 | 详细信息 |
|
某地模拟化工厂的贮氯罐发生泄漏进行安全演练。下列预案中,错误的是 A. 组织群众沿顺风方向疏散 B. 向贮氯罐周围的空气中喷洒稀NaOH溶液 C. 进入现场抢险的所有人员必须采取严密的防护措施 D. 若无法采取措施堵漏排险,可将贮氯罐浸入石灰乳水池中 |
|
| 7. 选择题 | 详细信息 |
|
下列描述中,不正确的是 A. 硅胶是用二氧化硅和水反应制得的 B. 水泥是以黏土和石灰石为原料制成的 C. 普通玻璃是以纯碱、石灰石和石英砂为原料制成的 D. 赏心悦目的雕花玻璃是用氢氟酸对玻璃刻蚀而成的 |
|
| 8. 选择题 | 详细信息 |
|
下列说法正确的是 A. 3p2表示3p能级有两个轨道 B. 同一原子中,1s、2s、3s电子的能量逐渐减小 C. 每个周期中最后一种元素的第一电离能最大 D. 短周期中,电负性(稀有气体未计)最大的元素是Na |
|
| 9. 选择题 | 详细信息 |
|
X2﹣的核外电子排布为2、8、8,则X元素在周期表中的位置是 A. 第三周期0族 B. 第三周期ⅥA族 C. 第四周期IA族 D. 第三周期ⅦA族 |
|
| 10. 选择题 | 详细信息 |
|
下列微粒的空间构型为平面三角形的是 A. H3O+ B. SO32- C. PCl3 D. BF3 |
|
| 11. 选择题 | 详细信息 |
|
根据元素周期表和周期律相关知识判断,下列说法正确的是 A. 硒(Se)元素的非金属性比硫强 B. Cl-、K+、Ca2+的离子半径最大的是Ca2+ C. Sr (OH)2(氢氧化锶)的碱性比Ca (OH)2弱 D. Be与Al的化学性质相似,BeO是两性氧化物 |
|
| 12. 选择题 | 详细信息 |
|
下列各项比较中前者高于(或大于或强于)后者的是 A. CH4在水中的溶解度和NH3在水中的溶解度 B. I2在水中的溶解度和I2在CCl4中的溶解度 C. I与H形成共价键的极性和F与H形成共价键的极性 D. 对羟基苯甲醛( |
|
| 13. 选择题 | 详细信息 |
|
下面的排序中,不正确的是 A. 熔点由高到低:Rb>K>Na B. 熔点由高到低:GeH4>SiH4>CH4 C. 硬度由大到小:金刚石>碳化硅>晶体硅 D. 晶格能由大到小: AlF3>MgF2>NaF |
|
| 14. 选择题 | 详细信息 |
|
实验室设计下列装置,能达到目的的是 A. 制取NH3  B. 干燥NH3 B. 干燥NH3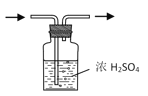 C. Cl2“喷泉”实验  D. 收集NO2 D. 收集NO2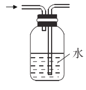 |
|
| 15. 选择题 | 详细信息 | |||||||||||||||
下表中:X、Y是主族元素,I为电离能,单位是kJ/mol。
|
||||||||||||||||
| 16. 选择题 | 详细信息 | |||||||||||||||
某学习小组研究为金属与硝酸的反应,进行如下实验:
|
||||||||||||||||
| 17. 选择题 | 详细信息 |
如图所示,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法中,正确的是 A. X和Y最多可形成4种化合物 B. YZ2分子的空间构型是V形 C. W和Z形成的共价化合物WZ4在常温下是固体 D. W、X、Y、Z的最简单氢化物中,W的氢化物沸点最高 |
|
| 18. 选择题 | 详细信息 |
有三种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是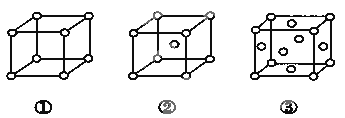 A. ①、②、③依次为简单立方堆积、六方最密堆积、体心立方堆积 B. 每个晶胞含有的原子数分别为:①1个,②2个,③6个 C. 晶胞中原子的配位数分别为:①6, ②8 ,③12 D. 空间利用率的大小关系为:①>②>③ |
|
| 19. 选择题 | 详细信息 |
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是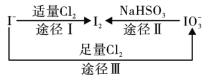 A. 氧化性的强弱顺序为:Cl2 >IO3- >I2 B. 一定条件下, I-与IO3-反应可能生成I2 C. 途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3 D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色 |
|
| 20. 选择题 | 详细信息 |
|
在焊接铜器时可用NH4Cl溶液除去铜器表面的氧化铜以便焊接,其反应为:CuO+NH4Cl → Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是 A. 反应中被氧化和被还原的元素分别为Cu和N B. 反应中氧化剂和还原剂的物质的量之比为3∶2 C. 反应中产生0.2 mol气体时,转移0.6 mol电子 D. 该反应中被还原的CuO占参与反应CuO的 |
|
| 21. 填空题 | 详细信息 |
|
按要求回答下列问题: (1)用电子式表示Cl2O的形成过程:________________________。 (2)用电子式表示K2S的形成过程:________________________。 (3)写出下列物质的电子式:Na2O2_______,N2_______ |
|
| 22. 填空题 | 详细信息 |
干冰、石墨、C60、氟化钙和金刚石的结构模型如图所示(石墨仅表示出其中的一层结构):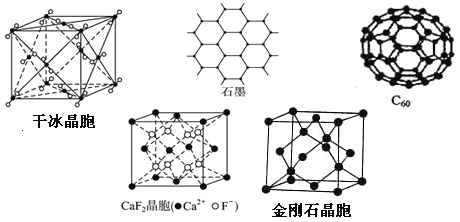 回答下列问题: (1)干冰晶胞中,每个CO2分子周围有________个与之紧邻且等距的CO2分子。 (2)由金刚石晶胞可知,每个金刚石晶胞占有________个碳原子。 (3)石墨层状结构中,平均每个正六边形占有的碳原子数是________。 (4)在CaF2晶体中,Ca2+的配位数是________,F-的配位数是________。 (5)固态时,C60属于________ (填“原子”或“分子”)晶体。 |
|
| 23. 推断题 | 详细信息 |
|
前四周期元素X、Y、Z、R、Q核电荷数逐渐增加,其中X、Y、Z、R四种元素的核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;R原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2;Q2+的价电子排布式为3d9。 回答下列问题: (1)R基态原子核外电子的排布式为________。 (2)Z元素的最高价氧化物对应的水化物化学式是___________。 (3)Y、Z分别与X形成最简单共价化合物A、B,A与B相比,稳定性较差的是______(写分子式)。 (4)在Q的硫酸盐溶液中逐滴加入氨水至形成配合物[Q(NH3)4]SO4,现象是_________。不考虑空间结构,配离子[Q(NH3)4]2+的结构可用示意图表示为_____(配位键用→标出)。 |
|
| 24. 综合题 | 详细信息 | ||||||||
|
第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题: (1)基态Ga原子价层电子的轨道表达式为_________________________,第一电离能介于N和B之间的第二周期元素有_______种。 (2)HCN分子中σ键与π键的数目之比为_______,其中σ键的对称方式为___________。与CN—互为等电子体的分子为___________。 (3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为_________。NF3的空间构型为____________。 (4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因_________________________________________________________。
|
|||||||||
| 25. 实验题 | 详细信息 | ||||||||||||
某化学学习小组研究盐酸被MnO2氧化的条件,进行如下实验。
|
|||||||||||||
| 26. 实验题 | 详细信息 | ||||||||||||
|
二氧化氯(ClO2)常用于处理含硫废水。某学习小组在实验室中探究ClO2与Na2S的反应。 已知:① ClO2是极易溶于水的黄绿色气体,有毒,沸点为11℃。 ② SO2 + NaClO3 + H2SO4→ ClO2 + NaHSO4(未配平) ③ ClO2 + NaOH→NaCl + NaClO3 + H2O(未配平) 请回答下列问题: (1)设计如下装置制备ClO2  ①装置A中反应的化学方程式为__________________________________。 ②装置B中反应的氧化剂与还原剂的物质的量之比为___________。 ③欲收集一定量的ClO2,选择上图中的装置,其连接顺序为a→ g→ h→ _________________→d。 (2)探究ClO2与Na2S的反应 将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物 
|
|||||||||||||
| 27. 计算题 | 详细信息 |
|
已知:① NO + NO2 + 2NaOH ② 2NO2 + 2NaOH 将51.2 g Cu溶于一定浓度的硝酸中,若生成的气体只含有NO、NO2,且这些气体恰好被500 mL2.0 mol/L的NaOH溶液完全吸收,得到只含NaNO2和NaNO3的溶液。求:气体中NO、NO2的物质的量分别为多少? |
|






