阆中中学2019年高二化学前半期期中考试带答案与解析
| 1. 选择题 | 详细信息 |
|
化学与生产、生活等息息相关,下列说法中错误的是 A.“华为P30 pro”手机中麒麟芯片的主要成分是单质硅 B.港珠澳大桥采用的超高分子量聚乙烯纤维吊绳,是有机高分子化合物 C.“地沟油”是一种质量极差、极不卫生的非食用油,可制肥皂、生物柴油等 D.人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用 |
|
| 2. 选择题 | 详细信息 |
|
关于资源开发利用不正确的是 A.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 B.电解氯化钠溶液制金属钠 C.煤的综合利用主要是指煤的干馏、煤的气化和液化 D.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法 |
|
| 3. 选择题 | 详细信息 |
|
下列关于有机物的说法正确的是 A.汽油和菜油的主要成分都是碳氢化合物 B.2-甲基丙烷也称为异丁烷 C.苯和甲苯的化学性质完全不同 D.淀粉和纤维素互为同分异构体 |
|
| 4. 选择题 | 详细信息 |
|
下列说法错误的是 A.与电源正极相连的是电解槽的阳极 B.黄铜(铜锌合金)制作的铜锣不易产生铜绿 C.在铁上镀铜,用纯铜作阳极,铁作阴极,电镀液中铜离子的浓度保持不变 D.钢铁发生电化学腐蚀的负极反应式:Fe - 3e- = Fe3+ |
|
| 5. 选择题 | 详细信息 | |||||||||||||||
下列实验操作和现象与结论的关系不相符的是
|
||||||||||||||||
| 6. 选择题 | 详细信息 |
关于如图所示装置的叙述正确的是( ) A. 甲、乙装置中的锌片都作负极 B. 甲、乙装置中的溶液内的H+在铜片被还原 C. 甲、乙装置中锌片上发生的反应都是还原反应 D. 甲装置中铜片有气泡生成,乙装置中的铜片质量减小 |
|
| 7. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的数值,下列说法不正确的是 A. 1mol分子式为C2H6O的物质,含O—H数一定是NA B. 标准状况下,22.4 L CH2=CH2中含C—H数为4 NA C. 1 mol甲基(—CH3)中含有的电子数为9 NA D. 0.1 mol由乙烯与乙醇组成的混合物完全燃烧所消耗的氧气分子数为0.3 NA |
|
| 8. 选择题 | 详细信息 |
下图是常见三种烃的比例模型示意图,下列说法正确的是 A. 甲、乙和丙的一氯代物都有两种 B. 甲和乙都能与酸性高锰酸钾溶液反应 C. 乙和丙分子中所有原子处于同一个平面上 D. 乙和丙都能与溴水反应 |
|
| 9. 选择题 | 详细信息 |
|
下列物质中沸点最高的是 A. CH3(CH2)3CH3 B. CH3(CH2)2CH3 C. (CH3)3CH D. (CH3)2CHCH2CH3 |
|
| 10. 选择题 | 详细信息 |
|
1 mol乙烯与Cl2完全加成后再与Cl2发生最大程度的取代,两个过程共需Cl2( ) A. 3mol B. 4mol C. 5mol D. 6mol |
|
| 11. 选择题 | 详细信息 |
|
“化学是五颜六色的”是指在化学实验中有着丰富多彩的颜色变化。下列有关反应获得的颜色不正确的是 ①红 ②橙 ③黄 ④绿 ⑤青 ⑥蓝 ⑦紫 A.乙烯通入酸性高锰酸钾溶液中:⑦ B.乙醇遇酸性重铬酸钾溶液:④ C.蛋白质遇浓硝酸:③ D.热的氧化铜遇酒精:① |
|
| 12. 选择题 | 详细信息 |
某有机物的结构见图,这种有机物不可能具有的性质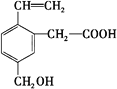 A.能发生水解反应 B.能发生酯化反应 C.能跟NaOH溶液反应 D.能使酸性KMnO4溶液褪色 |
|
| 13. 选择题 | 详细信息 |
已知铅蓄电池放电时电池反应为PbO2+Pb+4H++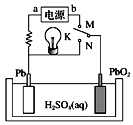 A.K与N连接时,该装置中电能转化为化学能 B.K与N连接时,H+向负极移动 C.K与M连接时,a为电源的负极 D.K与M连接时,阳极附近溶液的pH逐渐增大 |
|
| 14. 实验题 | 详细信息 |
实验室制取乙酸乙酯的装置如下图,按要求回答问题。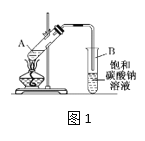 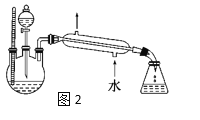 (1)写出制取乙酸乙酯的化学方程式_________________________。 (2)浓硫酸的作用是______,长导管末端不伸入饱和碳酸钠溶液的目的是______。 (3)上述实验中饱和碳酸钠溶液的作用是_______(填字母代号)。 A.反应掉乙酸和乙醇 B.反应掉乙酸并吸收部分乙醇 C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出 (4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),与图1装置相比,此装置的主要优点有______________。 |
|
| 15. 填空题 | 详细信息 |
某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。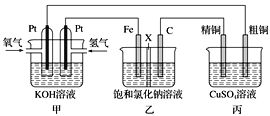 (1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。 (2)石墨电极为________ (填阳极或阴极),乙中总反应化学方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是_________。 (3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。 (4)若甲中消耗0.01mol O2,丙中精铜增重_________克。 |
|
| 16. 推断题 | 详细信息 |
工业中很多重要的原料都是来源于石油化工,回答下列问题。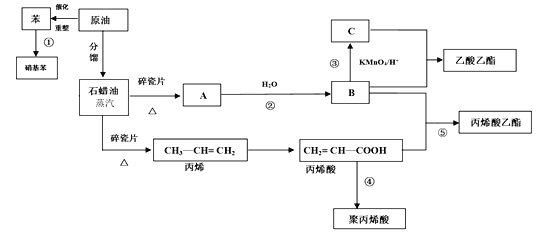 (1)丙烯酸中的官能团的名称为_______。 (2)反应①的化学方程式_______;反应⑤的化学方程式_______。 (3)丙烯酸(CH2 = CH—COOH)可能发生的反应有_______(填序号) A.加成反应 B.取代反应 C.加聚反应 D.中和反应 E.氧化反应 (4)聚丙烯酸的结构简式为______________。 |
|
| 17. | 详细信息 |
孔雀石的主要成分为CuCO3·Cu(OH)2。设计从孔雀石中冶炼铜的方案如下: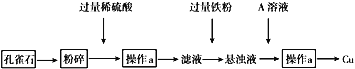 (1)将孔雀石粉碎的目的是_______,加入过量稀硫酸,可观察到的现象是_______。 (2)操作a的名称是_______,在滤液中加入过量铁粉发生的反应有___________(用离子方程式表示)。 (3)在悬浊液中加入A的目的是______________。 |
|
最近更新



