四川省成都市新都一中2021届高三9月月考理综化学试卷带参考答案和解析
| 1. 选择题 | 详细信息 |
|
面对突如其来的新型冠状病毒,越来越多人意识到口罩、医用酒精和双氧水的重要作用,医用口罩由三 层无纺布制成,无纺布的主要原料是聚丙烯树脂。下列说法正确的是( ) A.医用酒精和双氧水都是非电解质 B.聚丙烯树脂属于纯净物 C.双氧水用于家庭消毒利用双氧水的氧化性 D.抗病毒疫苗冷藏存放的目的是避免蛋白质被氧化 |
|
| 2. 选择题 | 详细信息 |
|
对于下列实验,能正确描述其反应的离子方程式是( ) A.向 CaCl2溶液中通入 CO2: Ca2+ +H2O+CO2 =CaCO3 +2H+ B.向 H2O2溶液中滴加少量 FeCl3: 2Fe3+ +H2O2 =O2 +2H+ +2Fe2+ C.同浓度同体积 NH4HSO4溶液与 NaOH 溶液混合: NH D.用 Na2SO3溶液吸收少量 Cl2: SO |
|
| 3. 选择题 | 详细信息 |
|
NA是阿伏加德罗常数的值。下列说法正确的是() A.22.4L(标准状况)氮气中含有7NA个电子 B.1mol重水比1mol水多NA个质子 C.12g石墨烯和12g金刚石均含有NA个碳原子 D.含1molFeCl3的溶液水解生成的胶体含NA个胶粒。 |
|
| 4. 选择题 | 详细信息 | ||||||||||||||||||||
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
|
|||||||||||||||||||||
| 5. 选择题 | 详细信息 |
|
LiAlH 是重要的储氢材料,可与水发生反应 :LiAH4+2H2O= LiAlO2+4H2↑。下列说法正确的是 A. 氢气既是氧化产物又是还原产物 B. LiAlH4既是氧化剂又是还原剂 C. 若生成标况下4.48 LH2, 则转移0.4 mol 电子 D. 还原剂与氧化剂的物质的量之比为2: 1 |
|
| 6. 选择题 | 详细信息 |
|
实验室以CaCO3为原料,制备CO2并获得CaCl2﹒6H2O晶体。下列图示装置和原理不能达到实验目的的是 A.制备CO2  B.收集CO2  C.滤去CaCO3  D.制得CaCl2﹒6H2O 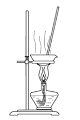 |
|
| 7. 选择题 | 详细信息 |
|
某含铬(Cr2O A.消耗硫酸亚铁铵的物质的量为n(2-x)mol B.处理废水中Cr2O C.反应中发生转移的电子总物质的量为3nx mol D.在FeO·FeyCrxO3中,3x=y |
|
| 8. | 详细信息 |
|
HNO2 是一种弱酸,且不稳定,易分解生成 NO 和 NO2;它能被常见的强氧化剂氧化; 在酸性溶液中它也是一种氧化剂,如能把 Fe2+氧化成 Fe3+。AgNO2 是一种难溶于水、易溶于酸的化合物, 试回答下列问题: (1)写出 HNO2 的电离方程式_____。 (2)人体正常的血红蛋白含有 Fe2+,若误食亚硝酸盐(如 NaNO2),则导致血红蛋白中的 Fe2+转化为 Fe3+而中毒,服用维生素 C 可解毒。下列叙述不正确的是_____(填字母)。 A 亚硝酸盐被还原 B 维生素 C 是还原剂 C 维生素 C 将 Fe3+还原为 Fe2+ D 亚硝酸盐是还原剂 (3)某同学把新制的氯水加到 NaNO2 溶液中,观察到氯水褪色,同时生成 NaNO3 和 HCl,请写出反应的离子方程式:_____。 (4)Fe 与过量稀硫酸反应可以制取 FeSO4,若用反应所得的酸性溶液,将 Fe2+转化为 Fe3+,要求产物纯净,可选用的最佳试剂是_____(填字母)。 a.Cl2 b.Fe c.H2O2 d.HNO3 (5)FeSO4 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钾(K2FeO4),氧化性比 Cl2、O2、ClO2、KMnO4 更强,主要反应:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。 ①该反应中的氧化剂是_____,还原剂是_____。 ②简要说明 K2FeO4 作为水处理剂时所起的作用_____。 (6)根据题给信息回答:鉴别NaNO2和NaCl的操作_________。 |
|
| 9. 填空题 | 详细信息 |
|
NaHSO4 可用作清洁剂、防腐剂等。 (1)下列关于 NaHSO4 的说法正确的是_____。 A.NaHSO4 固体不能导电 B.NaHSO4 溶液的导电性一定强于 CH3COOH 溶液 C.NaHSO4 属于电解质 D.NaHSO4 溶液显中性 (2)NaHSO4 溶液与 NaHCO3 溶液反应的离子方程式为_____。 (3)将 0.8 mol·L−1 NaHSO4 与 0.4 mol·L−1 Ba(OH)2 溶液等体积混合,发生反应的离子方程式为______;若在反应后的溶液中继续滴加 Ba(OH)2 溶液,反应的离子方程式为_________。 (4)在两份相同的 Ba(OH)2 溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。试回答 ①代表滴加_________溶液的变化曲线,b点,溶液中大量存在的离子是_____,曲线上对应的溶液显中性的点是______  |
|
| 10. 实验题 | 详细信息 | ||||||||||||
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下: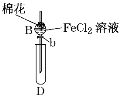 Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。 Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。 Ⅲ.接着再向B中通入一定量的SO2气体。 Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。 (1)棉花中浸润的溶液为____________,目的是________________。 (2)实验室制备氯气的化学方程式为______________________。 (3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。 (4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。 (5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
|
|||||||||||||
| 11. 填空题 | 详细信息 |
某溶液只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气味气体和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示。用该淡黄色物质做焰色反应,火焰呈黄色。 请回答下列问题: (1)所加的淡黄色固体是_______(写化学式)。 (2)生成气体的曲线是_____(填“Ⅰ”或“Ⅱ”)。 (3)生成气体的离子方程式为________________________。 (4)ab段发生反应的离子方程式为_____________________。 (5)原溶液中含有的离子是____________,所含离子的物质的量浓度之为_____。 |
|
最近更新



