雷山县第四中学高一化学上册期末考试同步考试检测
| 1. 选择题 | 详细信息 |
|
按Si、P、S、Cl的顺序,表现为递减的是( ) A.最外层电子数 B.原子半径 C.非金属性 D.最高正价 |
|
| 2. 选择题 | 详细信息 |
|
将少量氯水加入KI溶液中振荡,再加入CCl4,振荡,静置后观察到的现象是 A. 形成均匀的紫色溶液 B. 有紫色沉淀析出 C. 液体分层,上层呈紫红色 D. 液体分层,下层呈紫红色 |
|
| 3. 选择题 | 详细信息 |
|
日本福岛核电站3号反应堆使用铀钚混合燃料,也就是MOX燃料,传统的反应堆是以 A.238U和239Pu具有相同的中子数 B.235U和238U互为同位素 C.238U3+比235U3+具有更多的电子数 D.235U和238U为同一种核素 |
|
| 4. 选择题 | 详细信息 |
|
将等物质的量的Na2O2和Al同时放入足量的水中,充分反应后收集到混合气体4.48L(标准状况下),再向反应后的溶液中缓慢滴入1mol/L盐酸至沉淀恰好溶解。下列说法错误的是 A. 标准状况下,混合气体中氢气与氧气的体积比为3:1 B. 加入的固体过氧化钠为7.8g C. 当滴加200mL盐酸时,沉淀的质量达到最大值 D. 最终消耗的盐酸为400mL |
|
| 5. 选择题 | 详细信息 |
|
下列互为同位素的是( ) A.H2与D2 B.16O与16O2- C.16O与17O D.金刚石与石墨 |
|
| 6. 选择题 | 详细信息 |
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒,我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示: 下列有关该反应的叙述正确的是( ) A.该反应是复分解反应 B.该反应的化学方程式为Cl2+2NaClO2===2ClO2+2NaCl C.反应中Cl2既是氧化剂,又是还原剂 D.生成2 个ClO2时转移的电子数为6 个 |
|
| 7. 选择题 | 详细信息 |
|
下列物质转化不能通过一步反应直接实现的是 FeCl2 A. ① B. ② C. ③ D. ④ |
|
| 8. 选择题 | 详细信息 |
下表中金属难与表中其他金属形成二元合金的是( ) A.Cu、Fe B.Fe、Au C.Zn、W D.Cu、Ag |
|
| 9. 选择题 | 详细信息 |
|
下列说法错误的是( ) A. B. C. D. |
|
| 10. 选择题 | 详细信息 |
|
下列用电子式表示共价化合物的形成过程,正确的是( ) A.H+·C C.·Mg·+2· |
|
| 11. 选择题 | 详细信息 |
如图所示,在烧杯中加入水和苯(苯的密度为0.88g·cm-3,与水互不相溶,且不与钠反应)各50mL,将一小粒金属钠(密度为0.97g·cm-3)投入烧杯中,观察到的现象为( ) A.钠在水层中反应并四处游动 B.钠停留在苯层中不发生反应 C.钠在苯的液面上反应并四处游动 D.钠在苯与水的界面处反应并不断上浮、下沉 |
|
| 12. 选择题 | 详细信息 |
工业上用粗盐(含Ca2+、Mg2+、 A. 在“侯氏制碱法”中涉及到了氧化还原反应 B. 饱和食盐水中先通入的气体为CO2 C. 流程图中的系列操作中一定需要玻璃棒 D. 工艺中只有碳酸氢钠加热分解产生的CO2可回收循环利用 |
|
| 13. 选择题 | 详细信息 |
|
把agNa2O和bgNa2O2分别加入等质量的水中(水为足量),结果得到同质量分数的溶液,由此判断a与b的关系为 A.a=b B.a<b C.a>b D.无法确定 |
|
| 14. 选择题 | 详细信息 |
|
把11.2 g铁加入到500 mL盐酸中,在标准状况下放出氢气的体积是3.36 L,盐酸的物质的量浓度是( ) A.0.2 mol·L-1 B.0.3 mol·L-1 C.0.4 mol·L-1 D.0.6 mol·L-1 |
|
| 15. 选择题 | 详细信息 |
|
卤族元素的下列性质与它们原子的最外层电子数相等无关的是 A. 都能与钠反应 B. 都可以形成无氧酸 C. 氟没有正价 D. 均可形成氢化物 |
|
| 16. 选择题 | 详细信息 |
|
密度为0.910 g·cm-3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为( ) A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定 |
|
| 17. 选择题 | 详细信息 |
|
下列各组微粒中,在一定条件下均可以作氧化剂的是( ) A. Fe、H2O、CO2 B. Fe3+、MnO4—、NO3— C. Cl2、HClO、Mg D. ClO-、Cl-、Ag+ |
|
| 18. 选择题 | 详细信息 |
|
与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是 A.MgBr2 B.Na2S C.KCl D.K2S |
|
| 19. 选择题 | 详细信息 |
|
将质量分数为a%,物质的量浓度为c1mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数 变为2a%,此时该H2SO4的物质的量浓度为c2mol·L-1,则c1和c2的数值关系是 A. c2=2c1 B. c2>2c1 C. c2<2c1 D. 无法确定 |
|
| 20. 选择题 | 详细信息 |
|
碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多。还可用于电影制片、鞣革、选矿、冶炼、金属热处理,以及用于纤维、橡胶工业等,用途广泛。下列说法正确的是 ( ) A.用碳酸钠等碱性物质处理废水中的酸 B.碳酸氢钠药片是抗酸药,服用时喝些醋能提高药效 C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ D.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 |
|
| 21. 选择题 | 详细信息 |
|
某元素原子的最外层有1个电子,则该元素不可能是 A.IA族元素 B.金属元素 C.非金属元素 D.惰性元素 |
|
| 22. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( ) A.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA B.常温常压下,16gCH4所含中子数目为8NA C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA D.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA |
|
| 23. 选择题 | 详细信息 |
|
利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5 mol·L-1的Na2CO3溶液1 000 mL,假如其他操作均是正确无误的,下列情况会引起配制溶液的浓度偏高的是( ) A. 称取碳酸钠晶体100 g B. 定容时,俯视观察刻度线 C. 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 D. 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线 |
|
| 24. 选择题 | 详细信息 |
已知下述四个实验均能发生化学反应: 下列判断不正确的是( ) A.实验①中铁钉只做还原剂 B.实验②中Fe2+只显还原性 C.实验③中发生的是置换反应 D.上述实验证明:氧化性:Fe3+>Cu2+>Fe2+,Fe2+遇KSCN溶液无红色物质生成 |
|
| 25. 选择题 | 详细信息 |
|
以下关于锂、钠、钾、铷、铯的叙述中不正确的是( ) ①氢氧化物中碱性最强的是CsOH②单质熔点最高的是铯③单质都是热和电的良导体④单质的密度依次增大,且都比水轻⑤单质的还原性依次增强⑥对应阳离子的氧化性依次增强 A. ①③ B. ②⑤ C. ②④⑥ D. ①③⑤ |
|
| 26. 推断题 | 详细信息 |
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)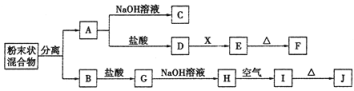 (1)写出下列物质的化学式:F____________,G________________。 (2)将混合物中两种金属分离开的最简单的方法是___________。 (3)D→E的转化中,加入过量的X可能是_____________________。 A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液 (4)写出下列转化的化学方程式: A→C:______________________________________________; H→I:_______________________________________________。 |
|
| 27. 实验题 | 详细信息 | ||||||||||||
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验仪器,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。 (1)A是制取CO2的装置,写出A中发生反应的离子方程式______________。 (2)填写表中空格:
|
|||||||||||||
| 28. 填空题 | 详细信息 |
下列物质之间有如下反应关系: 已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。 回答: (1) 写出下列物质的化学式:A______B______D________ 甲_______ 乙_______丙__________ (2) 写出E→C反应的化学方程式:_____________________ 。 |
|
| 29. 推断题 | 详细信息 |
已知甲、乙、丙是三种可溶性物质。其中甲是碱,乙、丙是盐,它们溶于水后电离产生的所有离子如下表所示: (1)甲的化学式为________________。 (2)乙溶液与丙溶液反应可生成气体M, 则M的化学式为________________,该反应的离子方程式为___________________________________________________。 (3)乙、丙溶液与甲溶液反应可分别生成白色沉淀A和B,其中B可溶于稀硝酸。 ①乙的化学式为________________,如何鉴别乙中的阴离子:___________________________。 ②B溶于稀硝酸的离子方程式为___________________________________________________。 |
|
| 30. 推断题 | 详细信息 |
铁和铝是科技、生产、生活中应用最广泛的金属材料。 现有铁、铝的混合物进行如下实验:  (1)操作X的名称是_____。 (2)气体A是_____。 (3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_____(填“氧化剂”或“还原剂”)。 (4)溶液B中阴离子除OH-外还有_____,溶液D中存在的金属离子为_____。 |
|
| 31. | 详细信息 |
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示: 据此流程图回答下列问题: (1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。 (2)②中Al2O3参与反应的离子方程式为__________。 (3)③中调节pH不能用CO2的理由是____________________。 (4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。 (5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。 (6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。 |
|
最近更新



