山东省济南市第一中学2021届高三上半期期中考试化学试卷带参考答案和解析
| 1. 选择题 | 详细信息 |
|
化学与生活密切相关,下列说法错误的是( ) A.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 C.将“84”消毒液与75%酒精1:1混合,消毒效果更好 D.电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法 |
|
| 2. 选择题 | 详细信息 |
实验是化学科学的基础。下列关于化学实验的表述正确的是( ) A.为除去KI固体中少量I2单质,溶解后采取如图所示操作 B.“凡渍药酒,皆须细切,……,便可漉出”,“漉出”指的是浸取 C.除去H2中混有的少量HCl,可通过盛有饱和NaHCO3溶液的洗气瓶 D.检验Fe2(SO4)3溶液中是否有FeSO4,可选用氯水和KSCN溶液 |
|
| 3. 选择题 | 详细信息 |
|
已知NA是阿伏加德罗常数的值,下列说法错误的是( ) A.20g20Ne含有的中子数为10NA B.100mL1mol·L-1亚硫酸钠溶液中含有的阴离子数目大于0.1NA C.4.6g乙醇和甲醚(CH3OCH3)的混合物中碳氢键数目为0.6NA D.0.1molS2O |
|
| 4. 选择题 | 详细信息 |
|
缺电子化合物是指电子数不符合路易斯结构(一个原子通过共用电子使其价层电子数达到8,H原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法错误的是( ) A.NH3、BF3、CCl4中只有BF3是缺电子化合物 B.BF3、CCl4中心原子的杂化方式分别为sp2、sp3 C.BF3与NH3反应时有配位键生成 D.CCl4的键角小于NH3 |
|
| 5. 选择题 | 详细信息 |
对某溶液中部分离子的定性检测流程如图。相关分析正确的是( ) A.步骤①所加试剂可以是浓KOH溶液 B.步骤①发生反应Al3++4NH3•H2O=Al(OH) C.可以用湿润的蓝色石蕊试纸检验生成的无色气体 D.步骤②发生反应Al3++3HCO |
|
| 6. 选择题 | 详细信息 |
氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。 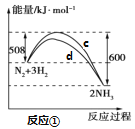 下列分析合理的是 A.如图中c曲线是加入催化剂a时的能量变化曲线 B.反应①的热化学方程式为:N2(g)+3H2(g) C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率 |
|
| 7. 选择题 | 详细信息 |
锂-空气电池是一种可充放电池,电池反应为2Li + O2 = Li2O2,某锂-空气电池的构造原理图如下。下列说法正确的是 A.可选用有机电解液或水性电解液 B.含催化剂的多孔电极为电池的负极 C.放电时正极的电极反应式为O2 + 2Li+ + 2e-= Li2O2 D.充电时锂电极应连接外接电源的正极 |
|
| 8. 选择题 | 详细信息 |
短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( ) A.Y、Z、W三种元素电负性:W>Z>Y B.Y、Z、W三种元素的第一电离能:W>Z>Y C.Y、Z、W与氢元素均可形成含非极性键的二元化合物 D.由X、Y、Z、W构成的化合物中可能含有离子键 |
|
| 9. 选择题 | 详细信息 |
|
著名的Vanviel反应为:12H2S+6CO2 A.该反应将光能转变为化学能 B.该反应原理应用于废气处理,有利于环境保护和资源再利用 C.每生成1molC6H12O6转移24×6.02×1023个电子 D.H2S、CO2均属于弱电解质 |
|
| 10. 选择题 | 详细信息 | ||||||||||||||||||||
下列实验操作、实验现象以及所得出的结论均正确的是( )
|
|||||||||||||||||||||
| 11. 选择题 | 详细信息 |
雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如图(Ce为铈元素): 下列说法错误的是( ) A.Na2S2O4中S元素的化合价为+3 B.装置Ⅱ消耗36g水生成4NA个H+(NA代表阿伏伽德罗常数) C.装置Ⅲ进行电解,Ce3+在阴极反应,使Ce4+得到再生 D.装置Ⅳ获得粗产品NH4NO3的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤等 |
|
| 12. 选择题 | 详细信息 |
|
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,主要制备方法方法如下: 湿法:Fe(OH)3+NaClO+NaOH→Na2FeO4+NaCl+H2O(反应未配平), 干法:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑ 则下列有关说法正确的是( ) A.高铁酸钾既有杀菌消毒的作用也有净水的作用 B.用湿法制备2molNa2FeO4需消耗3molNaClO C.干法中Na2O2只做氧化剂 D.干法中每生成1molNa2FeO4转移4mol电子 |
|
| 13. 选择题 | 详细信息 |
过二硫酸钾(K2S2O8)用于制作漂白剂、氧化剂,也可用作聚合引发剂。工业上电解饱和KHSO4的酸性溶液(含K+、H+、HSO A.该装置工作时,阳离子向B极移动 B.a极为电源正极,阴极室中盛有饱和KHSO4酸性溶液 C.A极反应:2HSO D.当转移0.2mol电子时,有0.2molH+通过质子交换膜 |
|
| 14. 选择题 | 详细信息 |
科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,Y的最外层电子数是其电子总数的 A.X元素是Si B.Y的最高价氧化物的水化物是强酸 C.元素非金属性的顺序为X<Y<Z D.W+离子的半径是同周期元素的离子半径中最大的 |
|
| 15. 选择题 | 详细信息 |
铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是( ) A.通过调节分液漏斗的活塞以控制①中气泡产生快慢 B.装置①的作用是干燥氢气 C.装置②、③中的药品分别是无水硫酸铜、碱石灰 D.④中澄清石灰水的作用是除去多余的尾气 |
|
| 16. | 详细信息 | ||||||||
|
减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g)⇌CH2O(g)+H2O(g) ∆H。请回答下列问题: (1)已知: ①CH2O(g)+O2(g)=CO2(g)+H2O(g) ∆H1=-480kJ/mol ②2H2(g)+O2(g)=2H2O(g) ∆H2 相关化学键的键能数据如表所示:
则CO2(g)+2H2(g)⇌CH2O(g)+H2O(g)∆H=______。 |
|||||||||
| 17. | 详细信息 |
|
Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。 (1)基态Co原子的价电子轨道表示式为______,Co3+核外3d能级上有_____对成对电子。 (2)铁氰化钾(K3[Fe(CN)6])溶液是检验Fe2+的常用试剂,1mol[Fe(CN)6]3+离子中所含σ键的数目为_____。 (3)Co3+的一种配离子[Co(N3)(NH3)5]2+中,配位体N (4)NiO的晶胞结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_____。已知Ni2+与O2-的最短距离为dnm,则NiO晶体的密度是_____g·cm-3。(已知NiO的摩尔质量为74.7g·mol-1)  |
|
| 18. | 详细信息 |
粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、MgO和SiO2等物质。用硫酸铵固体等试剂提取粉煤灰中Al2O3并制取铝的工艺流程如图: 回答下列问题: (1)已知烟气中含有NH3,煅烧工序中Al2O3参与反应的化学方程式为______。 (2)“滤渣Ⅰ”和“滤渣Ⅲ”主要成分的化学式分别为______、______。 (3)将“滤液Ⅱ”通过______、过滤、洗涤、干燥后得到的晶体可返回______工序中循环利用。 (4)向“滤液Ⅲ”中通入过量CO2,生成沉淀的离子方程式为______。 (5)电解Al2O3制备Al需要冰晶石(Na3AlF6)作助熔剂。Na3AlF6可由Al(OH)3、Na2CO3和HF反应制得,反应的化学方程式为______。 |
|
| 19. 实验题 | 详细信息 | |||||||||||||||
FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下: |
||||||||||||||||






