湖北省龙泉中学、荆州中学、宜昌一中2021届高三9月联考化学在线考试题免费练习
| 1. 选择题 | 详细信息 |
|
下列说法正确的是 A.冠状病毒粒子直径约60 B.装有无水硫酸铜的透气袋可以用作食品干燥剂 C.二氧化硅可用做计算机芯片 D.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性 |
|
| 2. 选择题 | 详细信息 |
|
下列表示正确的是 A.二氧化碳的比例模型: C.次氯酸的电子式: |
|
| 3. 选择题 | 详细信息 |
|
下列属于非电解质,但溶于水所得溶液能导电的是 A.干冰 B.液氯 C.生石灰 D.冰醋酸 |
|
| 4. 选择题 | 详细信息 |
|
下列说法不正确的是 A.铝盐、铁盐水解形成胶体,可用于净水 B.臭氧具有强氧化性,可用于泳池消毒 C.浓硫酸可使胆矾失去结晶水,体现了脱水性 D.浓硝酸常因溶解了二氧化氮而呈黄色 |
|
| 5. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是 A.2.8g乙烯中含有的共用电子对数目为0.5NA B.100mL18mol·L-1浓硫酸常温下与足量金属铜反应转移电子数为1.8NA C.标况下,2.24LHF中含有的分子数目为0.1NA D.18gC60和石墨的混合物中含有的碳原子数目为1.5NA |
|
| 6. 选择题 | 详细信息 |
|
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O下列判断不合理的是 A.Fe(NO3)x中的x为3 B.反应中每还原0.4mol氧化剂,就有1.2mol电子转移 C.稀HNO3在反应中表现氧化性和酸性 D.磁性氧化铁中的所有铁元素全部被氧化 |
|
| 7. 选择题 | 详细信息 |
用如图所示实验装置进行相关实验探究,其中装置或结论不合理的是 A.鉴别纯碱与小苏打,纯碱热稳定性弱于小苏打 B.证明Na2O2与水反应放热,观察到脱脂棉燃烧 C.证明Cl2能与烧碱溶液反应 D.探究钠与Cl2反应,右侧的棉花球可以吸收过量的氯气 |
|
| 8. 选择题 | 详细信息 |
|
解释下列原理的反应方程式不正确的是 A.高炉炼铁:3CO+Fe2O3 B.制漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O C.用过量NaOH去除烟气中SO2:SO2+OH-= D.提碘时用H2O2氧化I‑:H2O2+2I-+2H+=2H2O+I2 |
|
| 9. 选择题 | 详细信息 |
有机化合物X的结构简式如图,关于X的下列说法正确的是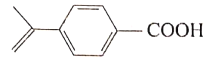 A.该有机物可发生加成反应、氧化反应、取代反应 B.所有原子一定共平面 C.苯环上的一氯代物有4种 D.最多可与5molH2发生加成反应 |
|
| 10. 选择题 | 详细信息 |
|
下列物质的转化在给定条件下不能实现的是 ① ② ③ ④ A.①④ B.①② C.②③ D.③④ |
|
| 11. 选择题 | 详细信息 |
|
下列化学实验事实及其解释或结论都正确的是 A.用玻璃棒蘸取待测液进行焰色反应,火焰呈黄色,说明待测液含钠元素 B.向某试液中加入盐酸酸化的BaCl2溶液,出现白色沉淀,则该试液中存在 C.向CuSO4溶液中加入KI溶液,有白色沉淀生成;再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI D.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
|
| 12. 选择题 | 详细信息 |
某固体混合物X可能含有MgO、SiO2、Fe2O3、Fe、Cu、CaCO3中的一种或几种物质,进行如下实验以确定其组成(反应都充分进行): 下列有关说法不正确的是 A.气体A中一定有CO2,可能有H2 B.固体A中一定有SiO2和Cu C.溶液A中一定含有Ca2+、Fe2+,一定没有Fe3+ D.浊液B中的沉淀可能有Mg(OH)2 |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||||||
由下列实验操作和现象得出的结论不正确的是
|
|||||||||||||||||||||
| 14. 选择题 | 详细信息 |
联氨(N2H4)可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是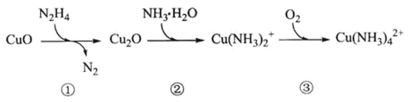 A.①转化中N2H4是还原剂 B.工业上也可使用Na2SO3处理锅炉水中的溶解氧 C.1molN2H4可处理水中1.5molO2 D.③中发生反应后溶液的pH减小 |
|
| 15. 选择题 | 详细信息 |
|
下列各组混合物的分离或提纯方法不正确的是 A.除去NaCl溶液中溶解的I2:加入CCl4萃取分液 B.除去Cl2中的HCl:通过饱和的食盐水 C.除去SO2中的H2S:通入足量酸性FeCl3溶液 D.除去CO2中的HCl:通过饱和碳酸钠溶液 |
|
| 16. 实验题 | 详细信息 |
|
二氧化氯(ClO2)是一种黄绿色气体,易溶于水,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题: (1)在处理废水时,ClO2可将废水中的 (2)某小组设计了如图所示的实验装置用于制备ClO2。 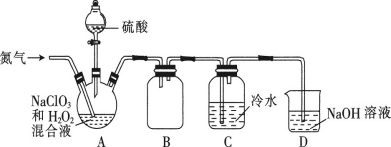 ①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是________________。 ②装置A用于生成ClO2气体,该反应的离子方程式为________________。 ③装置B的作用是____________________ ④当看到装置C中导管液面上升时应__________(选填“加快”或者“减慢”)氮气的通入速率。 (3)设计以下装置测ClO2的质量。如图所示: 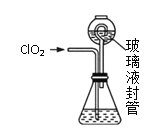 过程如下: 步骤1:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液; 步骤2:按照图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口; 步骤3:将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2~3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液; 步骤4:用cmol·L−1Na2S2O3标准液滴定锥形瓶中的液体,共用去VmLNa2S2O3溶液(已知:I2+2 ①装置中玻璃液封管的作用是_____________。 ②测得通入ClO2的质量m(ClO2)=___________g(用整理过的含c、V的代数式表示)。 |
|
| 17. 实验题 | 详细信息 | ||||||||||||||||||||||||||||
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应原理和装置图如下: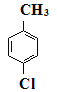 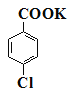 +MnO2 +MnO2   常温条件下的有关数据如下表所示:
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g。 |
|||||||||||||||||||||||||||||
| 18. | 详细信息 |
氟碳铈矿(主要成分为CeFCO3,还有其它稀土元素)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题: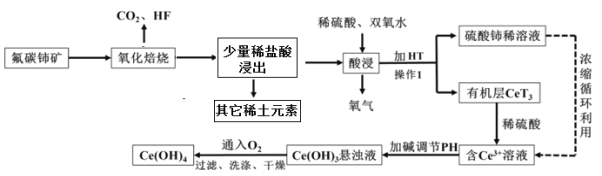 已知:铈的常见化合价为+3、+4。四价铈不易进入溶液,而三价铈易进入溶液。 (1)焙烧后生成CeO2,焙烧氟碳铈矿的目的是______________________。 (2)酸浸时双氧水的作用是____________。 (3)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________________________________。 (4)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+(水层)+3HT(有机层) (5)已知,298K时,Ksp[Ce(OH)3]=5×l0-20,若溶液中c(Ce3+)=0.05 mol·L-1,加碱调节pH到______________时Ce3+开始沉淀(忽略加碱过程中溶液体积变化)。 (6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:________________________。 |
|
| 19. | 详细信息 |
有机物G可用作光电材料,其一种合成路线如图: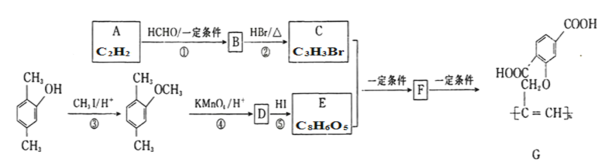 已知:① ② 回答下列问题: (1)A是一种烃,化学名称为________,反应①的反应类型是__________。 (2)反应②的化学方程式为____________,C中官能团的名称是________、___________。 (3)D的结构简式是____________。反应③和⑤的目的是______________。 (4)E有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式:__________、_________。 ①能与NaHCO3反应产生CO2; ②能发生银镜反应; ③能与FeCl3发生显色反应; ④核磁共振氢谱有4组峰。 (5)设计以1,2—二溴乙烷和甲醛为起始原料制备 |
|
| 20. 实验题 | 详细信息 |
(1)根据下图回答相关问题: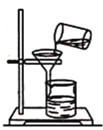 该图所示进行的是过滤操作,图中还缺少的仪器是________,其作用是___________。 (2)填写仪器名称: ①制取蒸馏水的受热容器是________。 ②石油蒸馏装置中通水冷却的仪器是____________。 ③用于分液的关键仪器是____________。 (3)已知,NaBiO3是一种不溶于水的固体,将其加入含有Mn2+的酸性溶液中,溶液变为紫红色,Bi元素变为无色的Bi3+。写出该反应的离子反应方程式_____________________。 (4)比较酸性强弱:H2SO4______HClO4(填“>”、“=”或“<”)。已知,次氯酸的酸性介于碳酸和碳酸氢根之间,比较ClO-、 |
|



