黑龙江省牡丹江市海林林业局第一中学2021届高三上学期第一次月考化学试卷带参考答案和解析
| 1. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,22.4 LCl2与Fe完全反应时,转移电子数为3NA B.17 g H2O2含有0.5NA个非极性共价键 C.在1 L 0.5 mol·L-1的H2SO4溶液中,含有的氧原子数为2NA D.常温常压下,23 g C2H6O中,一定含有2.5NA个C-H键 |
|
| 2. 选择题 | 详细信息 |
|
化学与生活密切相关。下列说法不正确的是 A. 流感疫苗需要冷冻保存的目的是防止蛋白质变性 B. 久置的青菜菜叶变黄与用SO2 漂白的纸张变黄的原理相同 C. 大力推广使用太阳能路灯,有利于节能减排 D. 被蜜蜂或蚂蚁蜇咬,可在伤口除抹肥皂水消肿止疼 |
|
| 3. 选择题 | 详细信息 |
|
下列关于水处理的说法不正确的是 A. 蒸馏法可淡化海水 B. ClO2、O3均可代替Cl2作为自来水消毒剂 C. Na2S做沉淀剂可处理含Cu2+、Hg2+的工业废水 D. 明矾在水中可以水解生成Al(OH)3胶体,起到杀菌消毒作用 |
|
| 4. 选择题 | 详细信息 |
|
下列解释实验现象的反应方程式正确的是 A.在CH3COONa溶液中,滴加酚酞变红:CH3COO- + H2O = CH3COOH + OH- B.在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2 + 2Cl- =2H2O + O2↑+ Cl2↑ C.将相互接触的铜片和锌片置于稀硫酸中,铜片表面有气泡产生:Cu + 2H+ = Cu2+ + H2↑ D.向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑色:Cu(OH)2(s) + S2- (aq) |
|
| 5. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A.pH=1的溶液中:Na+、K+、 B.0.1 mol·L-1 FeCl3溶液:K+、 C.使酚酞变红色的溶液:Na+、Al3+、 D.由水电离的c(H+)=1×10-13 mol·L-1的溶液:Na+、K+、 |
|
| 6. 选择题 | 详细信息 |
|
在一定条件下,下列粒子的还原性顺序为:Cl-<Br-<Fe2+<I-<SO2,由此判断以下各反应在溶液中不能发生的是( ) A. B. C. D. |
|
| 7. 选择题 | 详细信息 |
|
下列叙述正确的是 ( ) A. Na2O与Na2O2都是碱性氧化物 B.向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变 C.Na2O2用于呼吸面具,活性炭用于防毒面具,两者原理相同 D.62 g Na2O和78 g Na2O2,分别溶于等量且足量的水中,所得溶液中溶质质量分数相等 |
|
| 8. 选择题 | 详细信息 |
|
下列有关金属镁的说法不正确的是( ) A.Mg在CO2中燃烧生成MgO和C,是放热反应 B.工业上通过电解MgCl2溶液制取金属镁 C.Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率 D.镁可以用来制造信号弹和焰火,MgO可以作耐高温材料 |
|
| 9. 选择题 | 详细信息 |
|
由氧化铜、氧化铁、氧化锌组成的混合物ag,加入2mol/L硫酸50mL时固体恰好完全溶解,若将ag该混合物在足量的一氧化碳中加热充分反应,冷却后剩余固体的质量为 A.1.6g B.(a-1.6)g C.(a-3.2)g D.无法确定 |
|
| 10. 选择题 | 详细信息 |
|
在FeCl3和CuCl2的混合溶液中加入过量的铁粉,若充分反应后溶液的质量没有变化,则原混合溶液中Fe3+和Cu2+的物质的量浓度之比为( ) A.2∶7 B.1∶7 C.7∶1 D.5∶14 |
|
| 11. 选择题 | 详细信息 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法正确的是( ) A.相对于途径②③,途径①更好地体现了绿色化学思想 B.途径①发生的反应可能是3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O C.将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体 D.1 mol CuSO4在1100℃所得混合气体X为SO3和O2,其中O2可能为0.75 mol |
|
| 12. 选择题 | 详细信息 |
|
下列关于硅及其化合物的叙述错误的是( ) A.硅是良好的半导体材料,二氧化硅可用于制造光导纤维 B.二氧化硅能与石灰石反应:SiO2+CaCO3 C.可以用焦炭还原二氧化硅生产粗硅:SiO2+2C D.水泥的主要成分是Na2SiO3、CaSiO3和SiO2 |
|
| 13. 选择题 | 详细信息 |
|
硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是( ) A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4 B.碳化硅(SiC)的硬度大,熔点高,可用于制作砂纸、砂轮的磨料 C.祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO·Al2O3·6SiO2 D.二氧化硅为立体网状结构,其晶体中硅原子和硅氧单键的个数之比为1∶2 |
|
| 14. 选择题 | 详细信息 |
某同学用下列装置制备并检验Cl2的性质。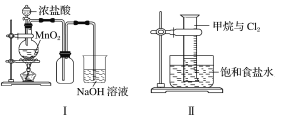  下列说法正确的是( ) A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗 B.Ⅱ图中:量筒中发生了加成反应 C.Ⅲ图中:发生的反应不是燃烧反应 D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
|
| 15. 选择题 | 详细信息 |
|
某混合溶液中含有NaI、NaBr、Na2SO4三种溶质,其物质的量均为1 mol,向混合溶液中通入一定量的氯气。下列说法正确的是( ) A. 将溶液蒸干最多可以得到4 mol NaCl B. 将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4 C. 向溶液中滴加淀粉KI溶液,溶液变蓝,则氯气一定过量 D. 若通入氯气的体积为22.4 L(标准状况),反应的离子方程式为2I-+Cl2===I2+2Cl- |
|
| 16. | 详细信息 |
|
有一瓶澄清的溶液,其中可能含有 ①用pH试纸检测,溶液呈强酸性。 ②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。 ③另取溶液适量,逐滴加入NaOH溶液: a.溶液从酸性变为中性 b.溶液中逐渐产生沉淀 c.沉淀完全溶解 d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。 根据上述实验现象,回答下列问题。 (1)由①可以排除______的存在。 (2)由②可以证明________的存在;同时排除_______的存在;理由是__________________。 (3)由③可以证明_________的存在;写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示: c.______________________;d.______________________。 |
|
| 17. 实验题 | 详细信息 | ||||||||||
绿矾(FeSO4·7H2O) 是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质) 为原料生产纯净绿矾的一种方法: 查询资料,得有关物质的数据如下表:
|
|||||||||||
| 18. 实验题 | 详细信息 |
某校化学兴趣小组为研究Cl2单质的性质,设计如图K13-7所示装置进行实验,装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。 (1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是_________________________________。 (2)加入药品前,检查Ⅰ中气体发生装置气密性的操作是___________________________________。 (3)装置Ⅱ的作用是_______________________________。 (4)实验过程中,装置Ⅳ中的实验现象为______________________________;发生反应的化学方程式为________________________________________。 (5)实验结束后,该组同学在装置Ⅲ中观察b的红色褪去,但是并未观察到“a无明显变化”这一预期现象,为了达到这一目的,你认为应在______(选填装置序号)之间还需添加洗气瓶,该装置的作用是____________________________________。 |
|
最近更新



