黑龙江省龙东南六校2020-2021年高一上册期末联考化学在线考试题带答案和解析
| 1. 选择题 | 详细信息 |
|
胶体区别于其他分散系的本质特征是: A.有丁达尔现象 B.有聚沉现象 C.可以无规则的运动 D.分散质粒子直径在1-100nm |
|
| 2. 选择题 | 详细信息 |
|
水溶液中能大量共存的一组离子是 A. C. |
|
| 3. 选择题 | 详细信息 |
|
下列关于反应KClO3+6HCl=KCl+3Cl2↑+2H2O的说法不正确的是( ) A. KClO3是氧化剂 B. H2O既不是氧化产物也不是还原产物 C. HCl是还原剂 D. KCl既是还原产物也是氧化产物 |
|
| 4. 选择题 | 详细信息 |
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( ) A. 钠悬浮在煤油层中 B. 钠静止在两液面之间 C. 钠沉入水底下 D. 钠在两液体界面附近上下跳动 |
|
| 5. 选择题 | 详细信息 |
|
1 mol CO和1 mol CO2具有相同的( ) ①分子数 ②原子数 ③C原子数 ④O原子数 A. ②④ B. ①③ C. ①④ D. ①② |
|
| 6. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数。下列叙述中正确的是( ) A. 标准状况下,22.4 L水中含有的水分子数为NA B. 4.0 g NaOH固体溶于100 mL水中,得到1 mol·L−1的NaOH溶液 C. 常温、常压下,22 g CO2中含有的氧原子数为NA D. 1 L 0.5 mol·L−1 Na2SO4溶液中,含有的氧原子总数为2NA |
|
| 7. 选择题 | 详细信息 |
|
下列溶液中的Cl- 浓度与50mL 1mol/L MgCl2溶液中的Cl- 浓度相等的是( ) A. 150 mL 1 mol/L NaCl溶液 B. 75 mL 2 mol/L CaCl2溶液 C. 150 mL 2 mol/L KCl溶液 D. 50 mL2 mol/L KClO3溶液 |
|
| 8. 选择题 | 详细信息 |
|
有关铁的氧化物的说法中,不正确的是( ) A.赤铁矿主要成分是Fe2O3,Fe2O3是红棕色的,常用作红色油漆和涂料 B.Fe3O4是黑色晶体,其中1/3的铁显+2价,2/3的铁显+3价 C.FeO、Fe2O3都不溶于水,但都能和盐酸反应生成相应的盐 D.FeO不稳定,在空气中加热迅速被氧化成Fe2O3 |
|
| 9. 选择题 | 详细信息 |
|
除去FeCl3溶液中的少量FeCl2杂质,可向其中加入适量的( ) A.Fe B.氯水 C.KSCN溶液 D.硝酸 |
|
| 10. 选择题 | 详细信息 |
|
下列有关Al与NaOH溶液反应的说法中,正确的是( ) A.铝是还原剂,其氧化产物是NaAlO2 B.NaOH是氧化剂,其还原产物是H2 C.Al是还原剂,H2O和NaOH都是氧化剂 D.水是氧化剂,铝被还原 |
|
| 11. 选择题 | 详细信息 |
|
A. B. C. D. |
|
| 12. 选择题 | 详细信息 |
|
下列关于元素周期表的说法正确的是( ) A. 元素周期表有7个周期,8个主族 B. 元素周期表有18个纵行,共16个族 C. 短周期元素中可能有副族元素 D. 元素周期表中的过渡元素就是副族元素 |
|
| 13. 选择题 | 详细信息 |
|
已知a为ⅡA族元素,b为ⅢA族元素,它们的原子序数分别为m和n,且a、b为同一周期元素,下列关系错误的是( ) A.n=m+1 B.n=m+11 C.n=m+25 D.n=m+10 |
|
| 14. 选择题 | 详细信息 |
|
如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素位于( ) A.ⅠB B.ⅣA C.ⅢA或ⅢB D.ⅠA |
|
| 15. 选择题 | 详细信息 |
|
下列叙述不正确的是( ) A. 在多电子原子里,核外电子的能量不同 B. 原子核外的电子按其能量不同分层排布 C. 电子的能量越低,运动区域离核越远 D. M层电子的能量大于L层电子的能量 |
|
| 16. 选择题 | 详细信息 |
|
已知在周期表中第118号元素位于周期表的第七周期0族,预测第114号元素的下列叙述中,错误的是 A. 位于周期表的第七周期第ⅣA族 B. 原子的最外层有4个电子 C. 肯定是非金属元素 D. 常见的化合价有+2和+4价 |
|
| 17. 选择题 | 详细信息 |
|
X元素最高价氧化物对应水化物的化学式为H2XO4,该元素的气态氢化物的化学式是( ) A.HX B.H2X C.XH3 D.XH4 |
|
| 18. 选择题 | 详细信息 |
|
A,B,C三种元素的原子序数依次为a、b、c,它们的离An+、Bn﹣、Cm﹣具有相同的电子层结构,且n>m,则下列关系正确的是 A.a>b>c B.a>c>b C.a=b+m﹣n D.a=c﹣n﹣m |
|
| 19. 选择题 | 详细信息 |
|
关于卤素(用X表示)的下列叙述正确的是( ) A.卤素单质与水反应均可用X2+H2O=HXO+HX表示 B.还原性:Cl->Br- C.卤素单质的密度从F2→I2随相对分子质量增大而增大 D.F2可以从NaCl溶液中置换出Cl2 |
|
| 20. 选择题 | 详细信息 |
|
X、Y、Z是周期表中相邻的三种元素。已知X和Y是同主族,Y和Z同周期,它们最外层上的电子数之和为16,则这三种元素可能是 A.Na、K、Ca B.N、P、S C.N、P、Si D.F、Cl、S |
|
| 21. 选择题 | 详细信息 |
|
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后生成的气体的体积比为甲∶乙=1∶2,则加入铝粉的质量为( ) A.5.4 g B.3.6 g C.2.7 g D.1.8 g |
|
| 22. 选择题 | 详细信息 |
|
36.5gHCl溶解在1L水中(水的密度近似为1 gmL-1),所得溶液的密度为ρ gmL-1,质量分数为w,物质的量浓度为c gmL-1,NA表示阿伏加德罗常数,下列说法正确的是( ) A.所得溶液的物质的量浓度:c=1 gmL-1 B.所得溶液中含有NA个HCl分子 C.36.5 gHCl气体占有的体积为22.4L D.所得溶液的质量分数: w= |
|
| 23. 选择题 | 详细信息 |
|
某种元素原子的质量是ag,12C原子的质量是bg,NA是阿伏加德罗常数的值,下列说法不正确的是( ) A.由已知信息可得NA= B.Wg该原子中含有 C.Wg该原子的物质的量一定是 D.该原子的摩尔质量是aNAg |
|
| 24. 选择题 | 详细信息 |
|
同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是 A. 物质的量之比为1:1 B. 体积之比为11:16 C. 氧原子数之比为1:1 D. 密度之比为11:16 |
|
| 25. 选择题 | 详细信息 |
|
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入100mL 1mol/L 的盐酸,恰好使混合物完全反应,放出 11.2mL(标准状况)气体,所得溶液加入 KSCN 溶液不变红色。用足量的CO 在高温下还原相同质量的此混合物,所得铁的质量为 A. 2.8g B. 11.2g C. 5.6g D. 无法计算 |
|
| 26. 实验题 | 详细信息 |
|
实验室欲配制480mL0.5mol·L-1的CuSO4溶液,据此回答下列问题: (1)需称量胆矾CuSO4.5H2O__g。 (2)在配制的过程中一定不需要使用到的仪器是(填写代号)__,还缺少的仪器有__、__。 A.烧杯 B.药匙 C.玻璃棒 D.1000mL容量瓶 E.锥形瓶 F.胶头滴管 (3)如图所示的实验操作的先后顺序为__。  (4)从配制好的CuSO4溶液中取出10mL,将这10mL的CuSO4溶液稀释至100mL,稀释后CuSO4溶液的浓度变为__mol·L-1。 (5)下列的实验操作可能导致配制的溶液浓度偏低的是__。 A.容量瓶内原来存有少量的水 B.定容时液面超过刻度线,用胶头滴管吸出 C.称量所需CuSO4.5H2O的质量时,物品与砝码的位置放反了(1g以下用游码) D.定容时俯视刻度线 |
|
| 27. | 详细信息 |
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。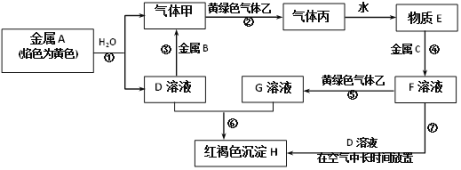 请根据以上信息完成下列各题: (1)写出下列物质的化学式:B_______,丙__________。 (2)写出实验室制备黄绿色气体乙的化学方程式:_______________, 反应过程⑦可能观察到的实验现象是:________________, 产生红褐色沉淀的化学方程式是 __________________, (3)反应③中的离子方程式是_______________, (4)向G溶液中加入H2S的离子方程式是_______________, (5)反应⑦中如果可以长时间看到白色沉淀,可采取哪些方法:________________(至少写出2条) |
|
| 28. | 详细信息 | ||||||||
现有部分元素的原子结构特点如表:
(1)画出W原子结构示意图___________。 |
|||||||||
| 29. 计算题 | 详细信息 |
|
现有14.4g由CO和 (1)该混合气体的平均摩尔质量为___________; (2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值); (3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下次测定)。 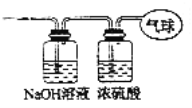 ①气球中收集到的气体的摩尔质量为___________; ②气球的体积为___________L; ③气球中收集到的气体,电子总数为___________ (用NA表示阿伏伽德罗常数的值)。 |
|
最近更新



