江西省南昌十中2020-2021年高二上册开学考试化学题带答案和解析
| 1. 选择题 | 详细信息 |
|
我国在探索太空、开发深海、建设高铁、5G 技术联通等方面取得举世瞩目的成就,这些成就与化学有着密切联系。下列说法正确的是( ) A.长征五号运载火箭箭体采用铝合金是为了美观耐用 B.大力发展太阳能、风能、氢能等新能源有利于生态文明建设 C.网络强国战略铺设光缆线路超三千万公里,光缆的主要成分是晶体硅 D.5G 手机电池工作时,电池中化学能完全转化为电能 |
|
| 2. 选择题 | 详细信息 |
|
下列反应原理不符合工业冶炼金属实际情况的是( ) A.2HgO C.2MgO |
|
| 3. 选择题 | 详细信息 |
|
NA 是阿伏加德罗常数的值。下列说法正确的是( ) A.5℃时,0.1mol/L 的 Ba(OH)2 溶液中含有的 OH-数目为0.2NA B.常温下,2.7g 打磨过的铝片投入到足量的浓硫酸中,铝失去的电子数为0.3NA C.标准状况下,6.72LNO2 与水充分反应转移的电子数目为0.1NA D.2.0gH218O 与 D2O 的混合物中所含中子数为NA |
|
| 4. 选择题 | 详细信息 |
|
下列关于硫酸、硝酸说法正确的是( ) A.纯锌与稀硫酸反应制氢气比粗锌慢,因为粗锌中含有比锌活泼的金属杂质 B.为增大铜与硝酸制取 NO 的反应速率,将稀硝酸改用浓硝酸 C.实验室用 75%的硫酸与亚硫酸钠制 SO2,比用 98%的浓硫酸速率快,因为 75%的硫酸 H+浓度大 D.铝片与稀硫酸反应,开始很缓慢,一段时间后反应速率加快,因为生成的Al3+有催化作用 |
|
| 5. 选择题 | 详细信息 |
海水开发利用的部分过程如图所示。下列说法错误的是 A. 向苦卤中通入Cl2是为了提取溴 B. 粗盐可采用除杂和重结晶等过程提纯 C. 工业生产中常选用NaOH作为沉淀剂 D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
|
| 6. 选择题 | 详细信息 |
下列说法正确的是( )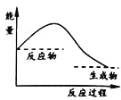 A.如图可以表示吸收能量的过程 B.化学反应过程中必然伴随着能量变化 C.该反应可能是氢氧化钡晶体与氯化铵晶体的反应 D.H2O(g)=H2O(l)过程中放出大量的热,该过程属于放热反应 |
|
| 7. 选择题 | 详细信息 | |||||||||||||||
2017 年 12 月 20 日,在第 74 次联合国全体会议上,宣布 2019 年为“国际化学元素周期表年”。元素 W、X、Y 和 Z 在周期表中的相对位置如图所示,其中元素 Z 位于第四周期,W、X、Y 原子的最外层电子数之和为 18.下列说法不正确的是( )
|
||||||||||||||||
| 8. 选择题 | 详细信息 |
化学键的键能是形成(或断开)1mol 化学键时释放(或吸收)的能量。已知白磷和 P4O6 的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198; P-O:360;O=O:497,若生成 1molP4O6,则反应 P4(白磷)+3O2 =P4O6 中的能量变化为( )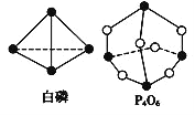 A.吸收 1641kJ 能量 B.放出 1641kJ 能量 C.吸收 126kJ 能量 D.放出 126kJ 能量 |
|
| 9. 选择题 | 详细信息 | |||||||||||||||
根据下列实验事实得出的相应结论正确的是
|
||||||||||||||||
| 10. 选择题 | 详细信息 |
|
将 64g 铜放入 300mL 某浓度硝酸中,当铜反应完全时,共收集到标准状况下 NO、NO2混合气体 22.4L,下列说法正确的是( ) A.硝酸在反应中只表现为强氧化性 B.NO 与 NO2的物质的量之比为 2∶1 C.参加反应硝酸的物质的量为 3mol D.原硝酸的浓度一定为 10mol/L |
|
| 11. | 详细信息 |
铝铁合金可在某些航天器件中替代钛铝合金,大幅度降低成本。如下实验流程可利用废弃的铝铁合金制备聚合硫酸铁和明矾: (1)操作Ⅰ是___________。 (2)试剂 X 为___________。 (3)写出“浸泡”过程中发生反应的离子方程式:___________。 (4)已知氧化性:Cl2>H2O2>Fe3+>I2>S,则试剂 Y 最佳选择是___________(填序号), 写出该反应的离子方程式___________。 A.H2O2 B.Cl2 C.S D.I2 (5)由 KAl(SO4)2溶液制 KAl(SO4)2•12H2O 固体需要经过:___________、___________、过滤、洗涤、干燥。 |
|
| 12. 填空题 | 详细信息 | ||||
1869 年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经 142 年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的回答下列问题。 (1)元素 Ga 在元素周期表中的位置为___________(写明周期和族)。 (2) Sn 的最高正价为___________,As 的气态氢化物为___________。 (3)根据元素周期律推断: ①阴影部分元素氢化物热稳定性最高的是___________(填化学式)。 ②H3AsO4、H2SeO4的酸性强弱:H3AsO4___________H2SeO4(填“>”、“<”或“=”)。 ③简单氢化物的熔沸点:H2O___________H2S(填“>”、“<”或“=”)。 (4)①Se2Cl2常用作分析试剂,其电子式为___________。 ②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___________(填字母)。 A.原子半径:In>Se B.In 的金属性比 Se 强 C.In 的金属性比 Al 弱 D.硒化铟的化学式为 InSe2 (5)请设计实验比较 C、Si 的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和 Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
|
|||||
| 13. 实验题 | 详细信息 |
Ⅰ氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用 NH3 将 NOx 还原生成N2.某同学在实验室中制备 NH3.回答下列问题: (1)氨气的发生装置可以选择上图中的___________,反应的化学方程式为___________。 (2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______→________→______→________→_______(按气流方向,用小写字母表示 )。 Ⅱ亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应: 2NOCl +H2O = 2HCl + NO↑+NO2↑。某化学兴趣小组设计如图装置用 Cl2 和 NO 制备 NOCl。回答下列相关问题:  (3)甲装置发生反应的离子方程式为___________, 装置丙中的液体为___________。 (4)实验时,先通入 Cl2,待丁中烧瓶内充满黄绿色气体时,再通入 NO,这样做的目的是___________。 (5)装置丁中冰盐水的作用是___________。 (6)经分析该套装置设计上有一处明显缺陷,改进方法是___________(用文字描述)。 (7)吸收尾气时,NOCl 发生反应的化学方程式为___________。 (已知:NO+NO2+2NaOH = 2NaNO2+H2O) (8)反应完成后,取烧瓶中所得产物 mg 溶于水,配制成 250mL 溶液,取出 25.00mL,再加入 VmL cmol/L AgNO3 溶液恰好完全反应,则产物中 NOCl 纯度(质量分数)的计算式为___________。 |
|
最近更新



