湖北省咸宁市通城二中2020-2021年高二前半期10月月考化学在线考试题免费练习
| 1. 选择题 | 详细信息 |
|
目前世界各国都在共同商讨如何应对气候变化、提升经济绿色水平,实现人类可持续发展。要想提升经济绿色水平下列属于最有希望的新能源是( ) ①天然气②煤③石油④水能⑤太阳能⑥地热能⑦风能⑧氢能 A.①②③④ B.③④⑤⑥ C.⑤⑥⑦⑧ D.除①②外 |
|
| 2. 选择题 | 详细信息 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: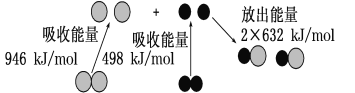 下列说法中正确的是( ) A.1molN2(g)和1molO2(g)反应吸收的能量为180kJ B.1molN2(g)和1molO2(g)具有的总能量大于2molNO(g)具有的总能量 C.通常情况下,N2(g)和O2(g)混合能直接生成NO D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
|
| 3. 选择题 | 详细信息 |
|
下列热化学方程式中,不正确的是( ) A.甲烷的燃烧热ΔH=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3kJ/mol B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) C.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=-57.3kJ/mol D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)ΔH=-571.6kJ/mol |
|
| 4. 选择题 | 详细信息 |
|
用CH4催化还原NOx,可以消除氮氧化物的污染。例如: ①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1 ②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1 下列说法不正确的是( ) A.若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ B.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1 C.反应①②转移的电子数相同 D.反应②中,当4.48 L CH4完全反应时转移的电子总数为1.60 mol |
|
| 5. 选择题 | 详细信息 |
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),如图表示该反应过程中能量(单位为kJ·mol-1)的变化。下列关于该反应的说法中,正确的是( )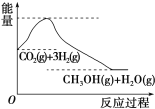 A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0 C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0 |
|
| 6. 选择题 | 详细信息 |
|
对于可逆反应:2A(g)+B(g) A.增大压强 B.升高温度 C.使用催化剂 D.多充入A |
|
| 7. 选择题 | 详细信息 |
|
以下说法中正确的是( ) A.ΔH<0的反应均是自发反应 B.自发进行的反应一定能迅速进行 C.高锰酸钾受热分解是一个熵减小的过程 D.冰在室温下自动融化成水,这是熵增的过程 |
|
| 8. 选择题 | 详细信息 |
|
将3 mol O2加入V L的反应器中,在高温下放电,经t1 s 建立了平衡体系:3O2 A.  B. B. C. C.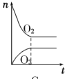 D. D.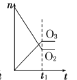 |
|
| 9. 选择题 | 详细信息 |
|
在恒温、体积为2L的密闭容器中进行反应:2A(g) A.v(B)=0.03mol·L-1·s-1 B.v(B)=0.045mol·L-1·s-1 C.v(C)=0.03mol·L-1·s-1 D.v(C)=0.06mol·L-1·s-1 |
|
| 10. 选择题 | 详细信息 |
|
对处于平衡状态的反应2A(g)+B(g) A.增大A浓度的瞬间,v(正)增大,v(逆)不变 B.升高温度,v(正)减小,v(逆)增大 C.减小压强,v(正)减小,v(逆)增大 D.降低温度,v(正)、v(逆)都增大 |
|
| 11. 选择题 | 详细信息 | ||||||||||||||||
t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)
下列说法正确的是( ) |
|||||||||||||||||
| 12. 选择题 | 详细信息 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生如下反应:A(g)+xB(g)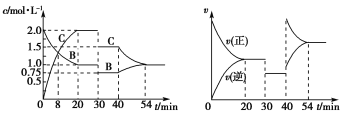 A.8min时表示正反应速率等于逆反应速率 B.前20minA的反应速率为0.5mol/(L·min) C.反应方程式中的x=1,30min时表示减小压强 D.40min时改变的条件是升高温度,且正反应为放热反应 |
|
| 13. 选择题 | 详细信息 |
在某密闭容器中,可逆反应:A(g)+B(g)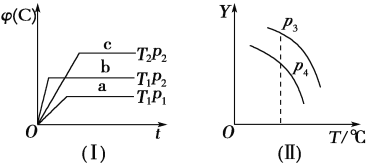 A.p3>p4,Y轴表示A的转化率 B.p3>p4,Y轴表示B的质量分数 C.p3>p4,Y轴表示A的物质的量 D.p3>p4,Y轴表示混合气体的平均相对分子质量 |
|
| 14. 选择题 | 详细信息 |
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g) A.图Ⅰ研究的是t0时升高温度对反应速率的影响 B.图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响 C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 D.图Ⅲ研究的是温度对化学平衡的影响,且甲的温度较高 |
|
| 15. 选择题 | 详细信息 |
|
肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。 已知200℃时: 反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g)ΔH1=−32.9kJ·mol−1; 反应Ⅱ:N2H4(g)+H2(g)=2NH3(g)ΔH2=−41.8kJ·mol−1 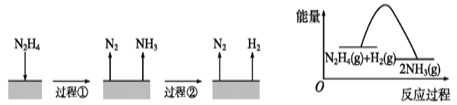 下列说法正确的是( ) A.图所示过程②是放热反应 B.反应Ⅱ的能量过程示意图如图所示 C.断开3molN2H4(g)中的化学键吸收的能量小于形成1molN2(g)的化学键释放的能量 D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g)ΔH=+50.7kJ·mol−1 |
|
| 16. 填空题 | 详细信息 |
|
氨(NH3)、肼(N2H4)是两种氮的氢化物。 (1)合成氨的反应是一个放热反应。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如图:  状态②、③、④中,能量最高的状态是___。 (2)已知途径Ⅰ两步转化反应的反应热分别为ΔH1、ΔH2,途径Ⅱ所示反应的反应热为ΔH,能否由途径Ⅰ的反应热推出途径Ⅱ的ΔH?___,(若能,请说明理由),(若不能,请说明还需补充的数据)___。 途径Ⅰ.N2 途径Ⅱ.N2 (3)发射卫星时用肼(N2H4)作燃料、二氧化氮(NO2)作氧化剂。 已知:①N2(g)+2O2(g)=2NO2(g) ΔH1= +67kJ·mol-1 ②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2= -500kJ·mol-1 写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:___。 (4)在微生物的作用下,NH 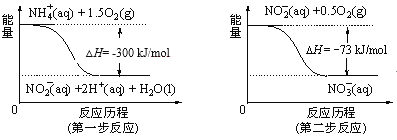 ①第一步反应是___(填“放热”或“吸热”)反应。 ②1molNH |
|
| 17. 填空题 | 详细信息 | ||||||||||||
|
利用太阳能光解水,制备的H2用于还原CO2合成甲醇,可实现资源的再利用。 (1)中国科学家研究的复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光高效分解水,其原理如图所示。反应Ⅰ的化学方程式为___。  (2)H2和CO、CO2在催化剂的作用下合成甲醇的主要反应如下: 第一步:CO2(g)+H2(g) 第二步:CO(g)+2H2(g) 第二步反应中的相关的化学键键能(E)数据如表,试计算x=___。
|
|||||||||||||
| 18. 填空题 | 详细信息 |
某温度时,在容积为2L的密闭容器中,A、B气体的物质的量随时间变化的曲线如图I所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。请据图回答下列问题: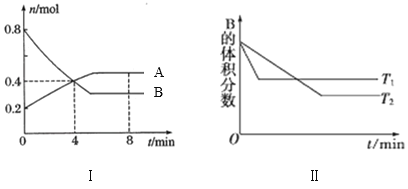 (1)该反应的化学方程式为____。正反应为____(填“吸热”或“放热”)反应。 (2)在4min末时,A、B的物质的量浓度c(A)___c(B),从0~4min内A、B的物质的量浓度变化量Δc(A)___Δc(B)(以上填“>”、“<”或“=”)。 (3)反应开始至4min时,A的平均反应速率为____。 (4)4min时,v(正)__(填“>”、“<”或“=”)v(逆)。 (5)8min后,改变下列某一条件,能使平衡向逆反应方向移动的有___(填字母)。 A.保持其他条件不变,增大压强 B.保持容器总体积不变,通入少量稀有气体 C.保持其他条件不变,升高温度 |
|
| 19. 填空题 | 详细信息 |
某温度下,向容积为1L的容器中充入1molNO和1molCO,发生2NO(g)+2CO(g) 回答下列问题: (1)该温度下,化学平衡常数K=____(用分数表示),平衡时CO的转化率为____。 (2)A点的正反应速率v正(CO)____(填“>”、“<”或“=”)B点的逆反应速率v逆(NO)。 (3)下列图像正确且能表明在时间t时刻反应一定处于平衡状态的是___。 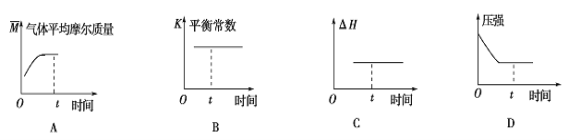 如果该反应达平衡后,降低温度,平衡常数减小,则ΔH___0(填“>”、“<”或“=”)。 (4)达平衡后,将容器的容积扩大一倍,下列说法正确的是___。 A.平衡向正反应方向移动 B.一氧化碳的浓度增大 C.平衡常数不变 D.CO的物质的量增大 (5)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,CO、N2的浓度之比 |
|
| 20. 填空题 | 详细信息 |
反应:aA(g)+bB(g) 回答问题: (1)平衡常数的表达式为____。 (2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A),其中最小的是___。 (3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最大的是___,其值是____。 (4)由第一次平衡到第二次平衡,平衡移动的方向是___,采取的措施是____。 (5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T3____T2(填“>”、“<”或“=”),判断的理由是___。 |
|
最近更新



