北京2019年九年级上册化学期末考试免费检测试卷
| 1. 选择题 | 详细信息 |
|
空气中含量最多的气体是 A. 氮气 B. 氧气 C. 二氧化碳 D. 稀有气体 |
|
| 2. | 详细信息 |
|
地壳中含量最多的金属元素是( ) A. O B. Si C. Al D. Fe |
|
| 3. 选择题 | 详细信息 |
|
下列符号中,能表示两个氧分子的是 A. 2O B. 2O2 C. O2 D. O2- |
|
| 4. 选择题 | 详细信息 |
|
能闻到花香的原因是 A. 分子的质量很小 B. 分子间有间隔 C. 分子在不断运动 D. 分子由原子构成 |
|
| 5. 选择题 | 详细信息 |
|
钛被称为航空金属,国产C919大飞机的钛合金用量达到9.3%。已知一种钛原子核内有22个质子和26个中子,该原子的核外电子数为 A. 4 B. 22 C. 26 D. 48 |
|
| 6. 选择题 | 详细信息 |
|
下列实验操作中,正确的是 A. 加热液体 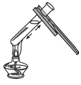 B. 过滤 B. 过滤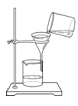 C. 取用粉末药品 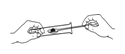 D. 倾倒液体 D. 倾倒液体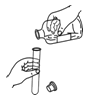 |
|
| 7. 选择题 | 详细信息 |
2019年是化学元素周期表问世150周年。国际权威机构IUPAC(国际纯粹与应用化学联合会)宣布中国科学家姜雪峰作为“硫元素代表”。硫元素在元素周期表中的信息如右图所示。下列说法中,不正确的是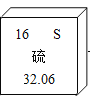 A. 原子序数是16 B. 属于非金属元素 C. 原子的核外电子数为16 D. 相对原子质量为32.06 g |
|
| 8. 选择题 | 详细信息 |
|
下列操作中,能鉴别空气、氧气和二氧化碳3瓶气体的是 A. 观察气体颜色 B. 插入燃着的木条 C. 插入带火星的木条 D. 倒入澄清石灰水 |
|
| 9. 选择题 | 详细信息 |
|
实验室用高锰酸钾制取氧气时有如下操作步骤:①检查装置的气密性;②装入药品,固定仪器;③熄灭酒精灯;④加热,用排水法收集气体;⑤从水槽中取出导气管。正确的操作顺序是 A. ①②④⑤③ B. ②①④⑤③ C. ②①③⑤④ D. ①②④③⑤ |
|
| 10. 选择题 | 详细信息 |
下图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号。下列有关该实验的说法中,正确的是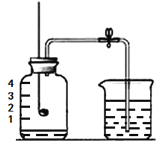 A. 红磷燃烧的化学方程式为P + O2 B. 红磷熄灭后,立刻打开弹簧夹 C. 最终瓶中剩余的气体是纯净的氮气 D. 瓶中液面最终上升至1处,证明空气中O2含量约为1/5体积 |
|
| 11. 选择题 | 详细信息 |
|
完全电解18 g水产生氧气的质量是 A. 2 g B. 4 g C. 16 g D. 32 g |
|
| 12. 选择题 | 详细信息 |
|
用小苏打(NaHCO3)、柠檬酸(C6H8O7)、蔗糖(C12H22O11)和纯净水自制碳酸饮料。已知:小苏打与柠檬酸发生的反应为3NaHCO3 + C6H8O7 === C6H5O7Na3 + 3H2O + 3CO2↑,下列说法中,不正确的是 A. NaHCO3由4种元素组成 B. C6H8O7中碳和氢元素的质量比为9:1 C. C12H22O11分子中氢、氧原子个数比为2:1 D. 自制碳酸饮料是由3种物质组成的混合物 |
|
| 13. 填空题 | 详细信息 | ||||||||||||||||
补齐连线。请从A或B两题中任选一个作答,若两题均作答,按A计分。
|
|||||||||||||||||
| 14. 填空题 | 详细信息 |
|
能源、环境与人类的生活和社会发展密切相关。 (1)目前人们使用的燃料大多来自化石燃料,如煤、石油、________等。 (2)开发和利用新能源是解决能源问题的重要途径。下列属于新能源的是________(填序号)。 A.潮汐能 B.太阳能 C.风能 (3)为减少污染、提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,其微观示意图如下所示: 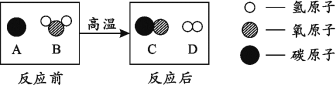 ①该过程发生的是______(填“物理”或“化学”)变化。 ②从微粒的角度分析,该过程中发生变化的是______(填序号)。 A.原子种类 B.原子数目 C.分子种类 |
|
| 15. 简答题 | 详细信息 |
开放性实践活动中,A、B、C三组同学,将葵花籽放入食盐水中浸泡12小时,捞出葵花籽,沥干水分后,用烤炉烤熟,制得咸瓜子。已知:室温为20oC,在此温度下,食盐的溶解度为36g。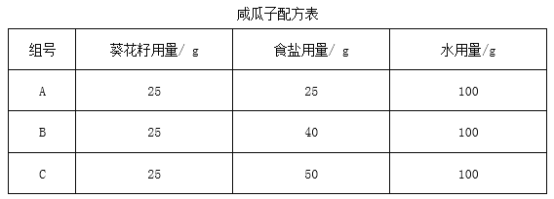 (1)“捞出葵花籽,沥干水分”应用的实验操作是_________。 (2)A组同学配制的食盐水中,溶质的质量分数为______%。 (3)B、C两组同学炒制的瓜子咸度是否相同并说明理由_________。 |
|
| 16. 综合题 | 详细信息 |
|
阅读下面科普短文(史实在线—水的组成的发现历程)。 古人认为,水是一种元素,不可再分。1766年,英国的科学家卡文迪许发现将金属锌加入到硫酸中,会产生一种无色气体,这种气体与空气混合后点燃,发生威力巨大的爆炸,他将这种气体叫做“可燃空气”。 同一时期,英国的科学家普利斯特里,也在研究这种“可燃空气”。这种气体密度只有空气的1/11。普利斯特里多次将这种猛烈的爆炸当作魔术在当时的欧洲贵族聚会上进行表演,直到某一次爆炸表演结束后,他发现玻璃容器的内壁有白雾。随后通过多次反复实验,确认这种白雾就是水。 1775年,法国科学家拉瓦锡通过实验验证空气不是一种元素,空气是一种混合物,其中氧气约占1/5。 1776年,瑞典科学家舍勒加热硝酸钾获得了比较纯净的氧气。 1781年,卡文迪许改进了原来的实验方案,他用纯净的氧气代替空气,发现“可燃空气”在纯氧中可以安静燃烧,发出蓝色火焰。他还发现1体积氧气和2体积“可燃空气”恰好完全反应,生成物只有水,没有别的物质。但卡文迪许未能突破传统观念的束缚,错误地用两种气体里都含有水这种“元素”,来解释所观察到的实验现象。 1782年,拉瓦锡将水蒸气通过1000多摄氏度高温金属铁管,获得了“可燃空气”和一种黑色固体。这个变化可以表示为:铁+水 1787年,拉瓦锡命名这种“可燃空气”为“氢气”,正式提出“氢”是一种元素。 1800年,英国科学家尼克尔森和卡里斯特尔用“伏打电池”在常温下进行了水的电解实验,获得成功,进一步证明了拉瓦锡的结论。 依据文章内容回答下列问题。 (1)“可燃空气”的物理性质有__________。 (2)“可燃空气”是_______(填“单质”或“化合物”)。 (3)已知1782年拉瓦锡实验中产生的黑色固体是四氧化三铁(Fe3O4)。写出该反应的化学方程式_____。 (4)根据已有知识分析上述史实,你认为可以证明水的组成的实验有________(填序号)。 A.普利斯特里爆炸实验 B.1781年卡文迪许实验 C.1782年拉瓦锡实验 D.1800年尼克尔森和卡里斯特尔实验 (5)获得的启示:化学上研究纯净物组成的方法有_____________(写出一种即可)。 |
|
| 17. 填空题 | 详细信息 |
半水煤气的主要成分是H2、CO、CO2、N2和水蒸气。工业上用半水煤气合成氨(NH3)的过程如下所示。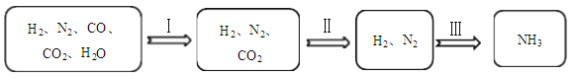 (1)过程Ⅰ中,反应为CO + H2O (2)过程Ⅲ中,发生的化学反应属于基本反应类型中的______反应。 |
|
| 18. 流程题 | 详细信息 |
甲醇(CH3OH)是无色、有酒精气味、易挥发的液体。甲醇裂解制氢气是用甲醇和水在一定温度、压强和催化剂作用下裂解转化生成氢气和二氧化碳。主要流程如下: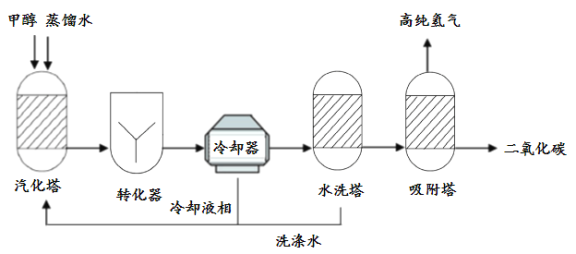 (1)原料汽化的目的是______。 (2)转化器中,主要发生的反应的化学方程式为______。 (3)吸附塔的作用是______。 |
|
| 19. 填空题 | 详细信息 |
用下图装置进行实验(夹持仪器略去;气密性已检验)。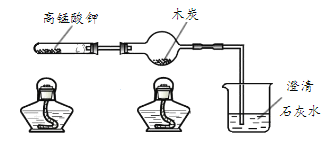 (1)高锰酸钾分解的化学方程式为______。 (2)实验过程中观察到的现象有木炭剧烈燃烧,发出白光,放热,澄清石灰水变浑浊。产生上述现象的原因是______(用化学方程式表示)。 |
|
| 20. 填空题 | 详细信息 |
用下图所示装置验证质量守恒定律。反应前称得总质量为m1,将小试管中的稀盐酸全部倒入烧杯,充分反应后,称得总质量为m2。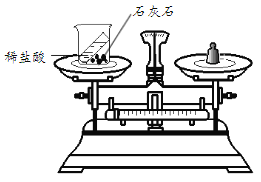 m1 _____ m2(填“﹥”、“﹦”或“﹤”),其原因是____________(用化学方程式表示)。 |
|
| 21. 简答题 | 详细信息 |
|
用下图所示实验装置验证可燃物燃烧的条件。 已知:白磷的着火点为40℃,红磷的着火点为240℃。 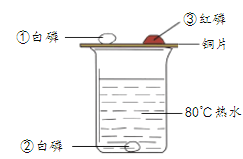 (1)烧杯中热水的作用是________。 (2)根据右图实验分析,对比______________的现象,可验证可燃物燃烧的条件之一是____________。 |
|
| 22. 简答题 | 详细信息 |
根据下图探究二氧化碳的性质(图中小花用紫色石蕊溶液浸泡并晾干)。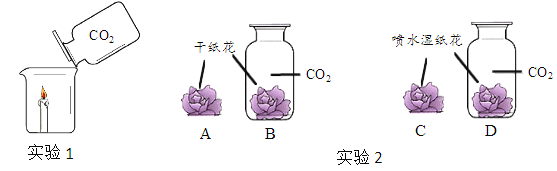 (1)实验1,将CO2倒入烧杯中,观察到燃烧的蜡烛熄灭,说明CO2具有的性质是______。 (2)实验2,能证明H2O和CO2发生了化学反应的现象是______。 |
|
| 23. 科学探究题 | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
金属钴(Co)在国防工业中有重要应用。在实验室用硫酸酸浸的方法从钴矿石中提取钴元素,并探究最佳提取条件。 (查阅资料)酸浸时发生如下反应: ① CoO + H2SO4 === CoSO4 + H2O ② 2Co2O3 + 4H2SO4 === 4CoSO4 + O2↑ + 4H2O ③ Co2O3 + 2H2SO4 + Na2SO3 === 2CoSO4 + 2H2O + Na2SO4 反应①~③中,化合价发生改变的元素有________。 (进行实验)将矿石在一定条件下酸浸4小时,测量钴元素的浸出率。部分数据如下:
|
|||||||||||||||||||||||||||||||||||||
最近更新



