зҰҸе»ә2019е№ҙй«ҳдёҖдёҠеҚҠе№ҙеҢ–еӯҰжңҹдёӯиҖғиҜ•зҪ‘з»ңиҖғиҜ•иҜ•еҚ·
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеҲҶзұ»жӯЈзЎ®зҡ„жҳҜпјҲ пјү A.й…’зІҫгҖҒж°Ёж°ҙгҖҒзәҜзўұеқҮдёәз”өи§ЈиҙЁ B.зЎ…й…ёгҖҒзЁҖиұҶжөҶгҖҒж°ҜеҢ–й“Ғжә¶ж¶ІеқҮдёәиғ¶дҪ“ C.зўҳй…’гҖҒйЈҹзӣҗж°ҙгҖҒзӣҗй…ёеқҮдёәж··еҗҲзү© D.SO2гҖҒCO2гҖҒCOеқҮдёәй…ёжҖ§ж°§еҢ–зү© |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҠ¶жҖҒзҡ„зү©иҙЁпјҢж—ўиғҪеҜјз”өеҸҲеұһдәҺз”өи§ЈиҙЁзҡ„жҳҜпјҲ пјү A.BaSO4жҷ¶дҪ“ B.NaClжә¶ж¶І C.ж¶ІжҖҒж°ҜеҢ–ж°ў D.зҶ”иһҚзҡ„KOH |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ( ) в‘ 1 mol O2зҡ„иҙЁйҮҸжҳҜ32 gВ·molпјҚ1в‘ЎH2зҡ„ж‘©е°”иҙЁйҮҸжҳҜ2 g в‘ў1 mol HпјӢзҡ„иҙЁйҮҸжҳҜ1 g в‘ЈеҜ№еҺҹеӯҗиҖҢиЁҖпјҢж‘©е°”иҙЁйҮҸе°ұжҳҜзӣёеҜ№еҺҹеӯҗиҙЁйҮҸ A. в‘ в‘Ўв‘ў B. в‘ўв‘Ј C. в‘ў D. в‘Ўв‘Ј |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
е°ҸжҳҺеңЁеҘҘиҝҗдә”иҝһзҺҜдёӯеЎ«е…ҘдәҶ5з§Қзү©иҙЁ(еҰӮеӣҫжүҖзӨә)пјҢзӣёиҝһзҺҜзҡ„зү©иҙЁй—ҙжүҖеҸ‘з”ҹзҡ„еҸҚеә”дёӯпјҢжІЎжңүж¶үеҸҠзҡ„еҹәжң¬еҸҚеә”зұ»еһӢжҳҜ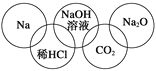 A.еҲҶи§ЈеҸҚеә” B.еӨҚеҲҶи§ЈеҸҚеә” C.еҢ–еҗҲеҸҚеә” D.зҪ®жҚўеҸҚеә” |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲ пјү A.з”ЁеӨ§зҗҶзҹідёҺзЁҖзӣҗй…ёеҲ¶дәҢж°§еҢ–зўіпјҡCO32пјҚ+2HпјӢ=H2O+CO2вҶ‘ B.зЎ«й…ёдёҺж°ўж°§еҢ–й’ жә¶ж¶Ізҡ„еҸҚеә”пјҡH++OH-=H2O C.зЎқ酸银дёҺж°ҜеҢ–й’ жә¶ж¶Ізҡ„еҸҚеә”пјҡAgNO3+Cl- =AgClвҶ“+NO3- D.й“қдёҺзЎ«й…ёй“ңжә¶ж¶Ізҡ„еҸҚеә”пјҡAl+Cu2+=Al3++Cu |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸдјҪеҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү A.еёёжё©еёёеҺӢдёӢпјҢ8gO2еҗ«жңү8NAдёӘиҙЁеӯҗ B.еҲҶеӯҗжҖ»ж•°дёәNAзҡ„CO2е’ҢNO2ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°дёә2NA C.ж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4Lзӣҗй…ёеҗ«жңүNAдёӘHC1еҲҶеӯҗ D.еҲҶеӯҗжҖ»ж•°дёәNAзҡ„COгҖҒN2ж··еҗҲж°”дҪ“дҪ“з§ҜзәҰдёә22.4LпјҢиҙЁйҮҸдёә28g |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯеҗ«еҲҶеӯҗж•°зӣ®жңҖеӨҡзҡ„жҳҜпјҲ пјү A.0.1molCl2 B.0.4gH2 C.4в„ғж—¶9mLH2O D.ж ҮеҶөдёӢ6.72L CO2 |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҗҢжё©еҗҢеҺӢдёӢпјҢзӯүдҪ“з§Ҝзҡ„NH3е’ҢCH4дёӨз§Қж°”дҪ“пјҢдёӢеҲ—жңүе…іиҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү A.жүҖеҗ«еҲҶеӯҗж•°зӣёеҗҢ B.иҙЁйҮҸд№ӢжҜ”дёә16:17 C.еҜҶеәҰд№ӢжҜ”дёә17:16 D.жүҖеҗ«ж°ўеҺҹеӯҗзү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә3:4 |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжҹҗж— иүІйҖҸжҳҺзҡ„й…ёжҖ§зҡ„жә¶ж¶ІдёӯиғҪе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜпјҲ пјү A.NH4+гҖҒNO3-гҖҒAl3+гҖҒCl- B.Fe2+гҖҒK+гҖҒClпјҚгҖҒNO3- C.MnO4-гҖҒK+гҖҒSO42-гҖҒNa+ D.K+гҖҒSO42-гҖҒHCO3-гҖҒNa+ |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӨдёӘе®№з§ҜзӣёеҗҢзҡ„е®№еҷЁдёӯпјҢдёҖдёӘзӣӣжңүHClж°”дҪ“пјҢеҸҰдёҖдёӘзӣӣжңүH2е’ҢCl2зҡ„ж··еҗҲж°”дҪ“гҖӮеңЁеҗҢжё©еҗҢеҺӢдёӢпјҢдёӨе®№еҷЁеҶ…зҡ„ж°”дҪ“дёҖе®ҡе…·жңүзӣёеҗҢзҡ„пјҲ пјү A.еҺҹеӯҗж•° B.еҜҶеәҰ C.иҙЁйҮҸ D.иҙЁеӯҗж•° |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжқЎд»¶дёӢпјҢ1дҪ“з§Ҝж°”дҪ“A2е’Ң3дҪ“з§Ҝж°”дҪ“B2е®Ңе…ЁеҸҚеә”з”ҹжҲҗдәҶ2дҪ“з§Ҝж°”дҪ“X(дҪ“з§ҜеңЁзӣёеҗҢжқЎд»¶дёӢжөӢе®ҡ)пјҢеҲҷXзҡ„еҢ–еӯҰејҸжҳҜгҖҖ(гҖҖгҖҖ) AпјҺABгҖҖгҖҖгҖҖBпјҺA2B2гҖҖгҖҖгҖҖCпјҺAB2гҖҖгҖҖгҖҖDпјҺAB3 |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ4gNaOHжә¶и§ЈеңЁ10mLж°ҙдёӯпјҢеҶҚзЁҖйҮҠжҲҗ1LпјҢд»ҺдёӯеҸ–еҮә10mLпјҢиҝҷ10mLжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰжҳҜпјҲ пјү A.1molВ·LпјҚ1 B.0.1molВ·LпјҚ1 C.0.001molВ·LпјҚ1 D.10molВ·LпјҚ1 |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
й…ҚеҲ¶0.1 molВ·LпјҚ1 зҡ„NaClжә¶ж¶ІпјҢдёӢеҲ—ж“ҚдҪңжүҖй…Қжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰеҒҸй«ҳзҡ„жҳҜ пјҲ пјү A. з§°йҮҸж—¶пјҢзү©з ҒеҖ’зҪ® B. е®ҡе®№ж—¶дҝҜи§ҶиҜ»еҸ–еҲ»еәҰ C. еҺҹе®№йҮҸ瓶жҙ—еҮҖеҗҺжңӘе№ІзҮҘ D. е®ҡе®№ж—¶ж¶Ійқўи¶…иҝҮдәҶеҲ»еәҰзәҝ |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ23 gй’ е’Ң24 gй•ҒеҲҶеҲ«ж”ҫе…ҘзӯүиҙЁйҮҸзҡ„иҝҮйҮҸзҡ„зЁҖзЎ«й…ёдёӯпјҢеҫ—еҲ°жә¶ж¶Ізҡ„иҙЁйҮҸеҲҶеҲ«дёәa gе’Ңb g пјҲи®ҫеҸҚеә”дёӯж°ҙеҲҶдёҚжҚҹеӨұпјүеҲҷaе’Ңbзҡ„е…ізі»дёә AпјҺaпјңb BпјҺaпјһb CпјҺa =b DпјҺж— жі•зЎ®е®ҡ |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
иғҪйүҙеҲ« NH4ClгҖҒNa2SO4гҖҒ(NH4)2SO4гҖҒKCl еӣӣз“¶ж— иүІжә¶ж¶Ізҡ„иҜ•еүӮжҳҜ A. Ba(OH)2жә¶ж¶І B. AgNO3жә¶ж¶І C. Ba(NO3)2жә¶ж¶І D. NaOHжә¶ж¶І |
|
| 16. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”еқҮеҸҜеңЁжә¶ж¶ІдёӯиҝӣиЎҢпјҢиғҪз”ЁеҗҢдёҖзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәзҡ„жҳҜпјҲ пјү A.Na2CO3гҖҒBaCO3еҲҶеҲ«дёҺзӣҗй…ёеҸҚеә” B.Ba(NO3)2гҖҒBa(OH)2еҲҶеҲ«дёҺзЁҖH2SO4еҸҚеә” C.Ca(NO3)2гҖҒCaCl2еҲҶеҲ«дёҺNa2CO3еҸҚеә” D.CuSO4гҖҒNa2SO4еҲҶеҲ«дёҺBa(OH)2еҸҚеә” |
|
| 17. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©еёёеҺӢдёӢпјҢз”ЁзӯүиҙЁйҮҸзҡ„ H2гҖҒN2гҖҒO2гҖҒCO2 еӣӣз§Қж°”дҪ“еҲҶеҲ«еҗ№еҮәеӣӣдёӘж°”зҗғпјҢе…¶дёӯеҗ№е…Ҙзҡ„ ж°”дҪ“дёә O2 зҡ„жҳҜ A.  C. C.  D. D.  |
|
| 18. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”ІгҖҒд№ҷгҖҒдёҷгҖҒдёҒеҲҶеҲ«жҳҜNa2CO3гҖҒAgNO3гҖҒBaCl2гҖҒзӣҗй…ёеӣӣз§Қж— иүІжә¶ж¶Ідёӯзҡ„дёҖз§ҚпјҢе®ғ们дёӨдёӨеҸҚеә”еҗҺзҡ„зҺ°иұЎеҰӮдёӢпјҡз”І+д№ҷвҶ’жІүж·Җпјӣз”І+дёҷвҶ’жІүж·Җпјӣд№ҷ+дёҷвҶ’жІүж·Җпјӣдёҷ+дёҒвҶ’жІүж·Җпјӣд№ҷ+дёҒвҶ’ж— иүІж— е‘іж°”дҪ“гҖӮеҲҷз”ІгҖҒд№ҷгҖҒдёҷгҖҒдёҒеӣӣз§Қжә¶ж¶Ідҫқж¬ЎжҳҜ A. BaCl2гҖҒNa2CO3гҖҒAgNO3гҖҒзӣҗй…ё B. BaCl2гҖҒNa2CO3гҖҒзӣҗй…ёгҖҒAgNO3 C. Na2CO3гҖҒзӣҗй…ёгҖҒAgNO3гҖҒBaCl2 D. AgNO3гҖҒзӣҗй…ёгҖҒBaCl2гҖҒNa2CO3 |
|
| 19. и§Јзӯ”йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
I.еҶҷеҮәдёӢеҲ—еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ пјҲ1пјүй’ дёҺж°ҙеҸҚеә”___пјӣ пјҲ2пјүиҝҮж°§еҢ–й’ дёҺдәҢж°§еҢ–зўі___пјӣ II.еҶҷеҮәдёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ пјҲ3пјүз”Ёе°ҸиӢҸжү“(NaHCO3)жІ»з–—иғғй…ё(дё»иҰҒжҲҗд»Ҫдёәзӣҗй…ё)иҝҮеӨҡпјҡ___пјӣ пјҲ4пјүзЁҖзЎ«й…ёдёӯеҠ ж°ўж°§еҢ–й’Ўжә¶ж¶ІиҮідёӯжҖ§пјҡ__гҖӮ |
|
| 20. и®Ўз®—йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјүд»Ҡжңүдә”з§Қзү©иҙЁпјҡв‘ й“ңзәҝ в‘ЎзҶ”еҢ–зҡ„NaCl в‘ўNaClжҷ¶дҪ“ в‘Јж°Ёж°” в‘Өж¶ІжҖҒж°ҜеҢ–ж°ўпјҢе…¶дёӯиғҪеҜјз”өзҡ„зү©иҙЁжҳҜ__пјӣеұһдәҺз”өи§ЈиҙЁзҡ„жҳҜ___пјӣеұһдәҺйқһз”өи§ЈиҙЁзҡ„жҳҜ___гҖӮ пјҲ2пјү0.5molH2SO4зҡ„иҙЁйҮҸжҳҜ__gпјҢиғҪдёӯе’Ң___molNaOHпјҢиҜҘзЎ«й…ёжүҖеҗ«ж°ўе…ғзҙ зҡ„иҙЁйҮҸдёҺ___molNH3дёӯжүҖеҗ«ж°ўе…ғзҙ зҡ„иҙЁйҮҸзӣёеҗҢгҖӮ пјҲ3пјүзӣёеҗҢиҙЁйҮҸзҡ„CH4е’ҢH2SдёӯеҲҶеӯҗдёӘж•°жҜ”дёә___гҖӮ пјҲ4пјүеңЁKClгҖҒMgCl2гҖҒMg(NO3)2еҪўжҲҗзҡ„ж··еҗҲжә¶ж¶ІдёӯпјҢn(K+)=0.2molпјҢn(Mg2+)=0.15molпјҢn(Cl-)=0.2molпјҢеҲҷn(NO3-)дёәпјҲ_____пјү AпјҺ0.05mol BпјҺ0.20mol CпјҺ0.30mol DпјҺ0.40mol |
|
| 21. жҺЁж–ӯйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж— иүІйҖҸжҳҺжә¶ж¶ІдёӯеҸҜиғҪеӨ§йҮҸеӯҳеңЁ K+гҖҒAg+гҖҒMg2+гҖҒCu2+гҖҒFe3+дёӯзҡ„еҮ з§ҚпјҢиҜ·жҢүиҰҒжұӮеЎ«з©әпјҡ пјҲ1пјүдёҚеҒҡд»»дҪ•е®һйӘҢе°ұеҸҜзЎ®е®ҡеҺҹжә¶ж¶ІдёӯдёҚеӯҳеңЁзҡ„зҰ»еӯҗжҳҜ___пјӣ пјҲ2пјүеҸ–е°‘йҮҸеҺҹжә¶ж¶ІпјҢеҠ е…ҘиҝҮйҮҸзЁҖзӣҗй…ёпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјӣеҶҚеҠ е…ҘиҝҮйҮҸзҡ„зЁҖзЎқй…ёпјҢжІүж·ҖдёҚж¶Ҳ еӨұгҖӮиҜҙжҳҺеҺҹжә¶ж¶ІдёӯиӮҜе®ҡеӯҳеңЁзҡ„зҰ»еӯҗжҳҜ___пјӣ пјҲ3пјүеҸ–пјҲ2пјүдёӯзҡ„ж»Өж¶ІпјҢеҠ е…ҘиҝҮйҮҸзҡ„ж°Ёж°ҙ(NH3В·H2O)пјҢеҮәзҺ°зҷҪиүІжІүж·Җ(е·ІзҹҘпјҡAg+е’Ңж°Ёж°ҙеҸҚеә”з”ҹжҲҗAg(NH3)2+е…¶еңЁжә¶ж¶Ідёӯж— иүІ)пјҢиҜҙжҳҺеҺҹжә¶ж¶ІиӮҜе®ҡжңү___пјӣ пјҲ4пјүжә¶ж¶ІдёӯеҸҜиғҪеӯҳеңЁзҡ„зҰ»еӯҗжҳҜ___пјӣ пјҲ5пјүеҺҹжә¶ж¶ІеӨ§йҮҸеӯҳеңЁзҡ„йҳҙзҰ»еӯҗеҸҜиғҪжҳҜдёӢеҲ—дёӯзҡ„___гҖӮ AпјҺCl- BпјҺNO3- CпјҺCO32- DпјҺOH- |
|
| 22. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ |
I.еҰӮеӣҫжҳҜдёҖеҘ—еҲ¶еҸ–并йӘҢиҜҒж°Ҝж°”йғЁеҲҶеҢ–еӯҰжҖ§иҙЁзҡ„е®һйӘҢиЈ…зҪ®пјҲиЈ…зҪ®AеҲ¶еҸ–ж°Ҝж°”пјүгҖӮ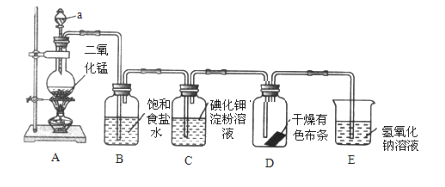 еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҪ“Cl2жҢҒз»ӯйҖҡиҝҮж—¶пјҢиЈ…зҪ®Dдёӯе№ІзҮҘзҡ„жңүиүІеёғжқЎиғҪеҗҰиӨӘиүІпјҹдёәд»Җд№Ҳпјҹ__пјҢ__гҖӮ пјҲ2пјүиӢҘиҰҒиҜҒжҳҺе№ІзҮҘзҡ„Cl2ж— жјӮзҷҪжҖ§пјҢеҸҜеңЁиЈ…зҪ®DеүҚж·»еҠ дёҖдёӘиЈ…жңү__зҡ„жҙ—气瓶гҖӮ пјҲ3пјүиЈ…зҪ®Eзҡ„дҪңз”ЁжҳҜ___пјҢиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә__гҖӮ II.ж¬Із”Ё98%зҡ„жө“зЎ«й…ёпјҲеҜҶеәҰдёә1.84gВ·cmпјҚ3пјүй…ҚеҲ¶жҲҗжө“еәҰдёә0.5molВ·LпјҚ1зҡ„зЁҖзЎ«й…ё500mLгҖӮ пјҲ4пјүжүҖйңҖжө“зЎ«й…ёзҡ„дҪ“з§Ҝдёә___mLгҖӮ пјҲ5пјүйҖүз”Ёзҡ„дё»иҰҒд»ӘеҷЁжңүпјҡзғ§жқҜгҖҒйҮҸзӯ’гҖҒиғ¶еӨҙж»ҙз®ЎгҖҒзҺ»з’ғжЈ’е’Ң___гҖӮ пјҲ6пјүж“ҚдҪңжӯЈзЎ®зҡ„йЎәеәҸдёә___пјҲеЎ«еәҸеҸ·пјүгҖӮ AпјҺз”ЁйҮҸзӯ’йҮҸеҸ–жө“зЎ«й…ё BпјҺеҸҚеӨҚйў еҖ’ж‘ҮеҢҖ CпјҺз”Ёиғ¶еӨҙж»ҙз®ЎеҠ ж°ҙиҮіеҲ»еәҰ DпјҺе°Ҷй…ҚеҲ¶еҘҪзҡ„жә¶ж¶ІиҪ¬е…ҘиҜ•еүӮ瓶дёӯиҙҙдёҠж Үзӯҫ EпјҺзЁҖйҮҠжө“зЎ«й…ё FпјҺе°Ҷжә¶ж¶ІиҪ¬е…Ҙе®№йҮҸ瓶 пјҲ7пјүеңЁе®һйӘҢдёӯе…¶д»–ж“ҚдҪңеқҮжӯЈзЎ®пјҢиӢҘе®ҡе®№ж—¶д»°и§ҶеҲ»еәҰзәҝпјҢеҲҷжүҖеҫ—жә¶ж¶Іжө“еәҰ___0.5molВ·L-1(еЎ«вҖңеӨ§дәҺвҖқвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқ)гҖӮ пјҲ8пјүиҜҘеҗҢеӯҰеңЁе®ҡе®№еҗҺпјҢеҠ зӣ–еҖ’иҪ¬ж‘ҮеҢҖеҗҺпјҢеҸ‘зҺ°ж¶ІйқўдҪҺдәҺеҲ»еәҰзәҝпјҢеҸҲж»ҙеҠ и’ёйҰҸж°ҙиҮіеҲ»еәҰгҖӮеҜ№жүҖй…Қжә¶ж¶Іжө“еәҰзҡ„еҪұе“Қ__(еЎ«вҖңеҒҸй«ҳвҖқгҖҒвҖңеҒҸдҪҺвҖқжҲ–вҖңж— еҪұе“ҚвҖқ)гҖӮ |
|
| 23. и®Ўз®—йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјү6.4gMе’Ң17.0gNжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢз”ҹжҲҗ0.4molXе’Ң12.2gYпјҢеҲҷXзҡ„ж‘©е°”иҙЁйҮҸдёәпјҡ___гҖӮ пјҲ2пјүе®һйӘҢе®ӨйңҖиҰҒеҲ¶еӨҮ22.4LпјҲж ҮеҮҶзҠ¶еҶөпјүH2пјҢзҺ°з”ЁиҙЁйҮҸеҲҶж•°дёә90.0%зҡ„й”ҢзІ’дёҺи¶ійҮҸзҡ„зЁҖзӣҗй…ёеҸҚеә”пјҲеҒҮи®ҫжқӮиҙЁдёҚдёҺзЁҖзӣҗй…ёеҸҚеә”пјүпјҢй—®пјҡпјҲиҰҒжұӮеҶҷеҮәи®Ўз®—иҝҮзЁӢпјү в‘ иҮіе°‘йңҖиҰҒиҙЁйҮҸеҲҶж•°дёә90.0%зҡ„й”ҢзІ’еӨҡе°‘е…Ӣпјҹ___ в‘Ўз”ҹжҲҗзҡ„ж°ҜеҢ–й”Ңзҡ„зү©иҙЁзҡ„йҮҸжҳҜеӨҡе°‘пјҹ___ |
|
й«ҳдёӯеҢ–еӯҰ иҜ•еҚ·жҺЁиҚҗ
- иҙөе·һ2019е№ҙй«ҳдёүеҢ–еӯҰдёӢеҶҢй«ҳиҖғжЁЎжӢҹзҪ‘дёҠеңЁзәҝеҒҡйўҳ
- 2019-2020е№ҙй«ҳдәҢ9жңҲи°ғз ”еҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲж№–еҢ—зңҒеӯқж„ҹй«ҳзә§дёӯеӯҰпјү
- еҚ—йҳіеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·жЁЎжӢҹиҖғиҜ•з»ғд№
- 2017-2018е№ҙй«ҳдёҖеҢ–еӯҰ第дёҖеӯҰжңҹеҸҚеә”еҺҹзҗҶз»јеҗҲжөӢеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲдёҠжө·еёӮпјү
- 2019-2020е№ҙй«ҳдәҢдёҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲж№–еҚ—зңҒйӮөдёңеҺҝеҲӣж–°е®һйӘҢеӯҰж Ўпјү
- жөҺе®ҒеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•ж‘ёеә•иҖғиҜ•йўҳеҗҢжӯҘи®ӯз»ғ
- 2020еұҠдәәж•ҷзүҲй«ҳдёүеҢ–еӯҰдәҢиҪ®еӨҚд№ йқһйҖүжӢ©йўҳдё“ж”»з»ғ--е·ҘиүәжөҒзЁӢ
- зҰҸе»әй«ҳдёҖеҢ–еӯҰ2019е№ҙеҗҺеҚҠжңҹжңҹдёӯиҖғиҜ•иҜ•еҚ·е®Ңж•ҙзүҲ
жңҖиҝ‘жӣҙж–°



