北京市海淀区北京实验学校2020-2021年九年级上半年期中化学专题训练
| 1. 选择题 | 详细信息 |
|
通过实验测定了空气的组成的科学家是 A. 门捷列夫 B. 道尔顿 C. 拉瓦锡 D. 阿伏伽德罗 |
|
| 2. 选择题 | 详细信息 |
|
地壳中含量最多的元素是( ) A. Si B. Al C. O D. Fe |
|
| 3. 选择题 | 详细信息 |
|
下列物质在氧气中燃烧,产生白烟的是 A.铁丝 B.硫粉 C.蜡烛 D.红磷 |
|
| 4. 选择题 | 详细信息 |
|
运送汽油的罐车上,应该张贴的图标是( ) A.  B. B.  C.  D. D.  |
|
| 5. 选择题 | 详细信息 |
|
决定元素种类的是 A. 中子数 B. 质子数 C. 核外电子数 D. 最外层电子数 |
|
| 6. 选择题 | 详细信息 |
|
生活中常用于降低水的硬度的方法是 A.加肥皂水 B.吸附 C.加热煮沸 D.过滤 |
|
| 7. | 详细信息 |
下列实验操作正确的是 A. 取用液体 B. 倾倒液体 C. 读取液体体积 D. 点燃酒精灯 |
|
| 8. 选择题 | 详细信息 |
|
下列微粒中,能表示2个氢分子的是 A. 2H B. 2 C. |
|
| 9. 选择题 | 详细信息 |
|
下列现象中,主要与物质的物理性质有关的是 A.石蜡熔化 B.纸张燃烧 C.食物腐烂 D.铁生锈 |
|
| 10. 选择题 | 详细信息 |
|
一种铁原子的原子核内有 26 个质子和 30 个中子,该原子的核外电子数为 A.4 B.26 C.30 D.56 |
|
| 11. 选择题 | 详细信息 |
|
下列物质的化学式书写不正确的是 A.氢气H2 B.高锰酸钾KMnO4 C.氧化铁Fe3O4 D.五氧化二磷P2O5 |
|
| 12. 选择题 | 详细信息 |
下列粒子中属于阴离子的是 |
|
| 13. 选择题 | 详细信息 |
|
下列物质由分子构成的是 A.氮气 B.铁 C.汞 D.氯化钠 |
|
| 14. 选择题 | 详细信息 |
|
长征5号运载火箭中采用了液氢﹣液氧发动机,根据信息回答19﹣20题 关于选用液氢和液氧的说法中,不正确的是( ) A. 与气态相比,液氢和液氧的分子间隔更小,节约空间 B. 氢气、氧气经液化后,其化学性质没有发生改变 C. 汽化后,产生的氢气和氧气都是可燃物 D. 燃烧反应的产物是水,不会污染环境 |
|
| 15. 选择题 | 详细信息 |
|
长征5号运载火箭中采用了液氢﹣液氧发动机,根据信息回答19﹣20题 氢气与氧气的反应放出大量热,是火箭的动力来源该反应的微观示意图如图。下列说法不正确的是  A. 1个氧分子中含有2个氧原子 B. 该反应涉及的物质均属于单质 C. 水分子的相对分子质量为18 D. 产物中含有氢、氧两种元素 |
|
| 16. 选择题 | 详细信息 |
根据如图,下列关于氢气与氧气反应的说法中,正确的是 A.反应前后,氢分子没有发生改变 B.反应前后,氧原子的个数有所减少 C.参加反应的氢分子与氧分子的个数比为2:1 D.参加反应的氢分子与氧分子的质量比为2:1 |
|
| 17. 选择题 | 详细信息 | |||||||||||||||
下列实验方案与结论不相对应的是
|
||||||||||||||||
| 18. 填空题 | 详细信息 |
空气是宝贵的资源,探究其成分并应用于生活。如图为空气成分示意图(按体积计算),其中“c”代表的是_____。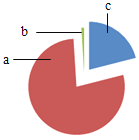 A 氧气 B 氮气 C 二氧化碳 D 稀有气体 |
|
| 19. 选择题 | 详细信息 |
下列展品制造时所发生的变化主要为化学变化的是 (填序号)。   A.用岩石打制石器 B.用泥土烧制青瓷烛台 C.用玉石雕刻玉印 |
|
| 20. 填空题 | 详细信息 |
| 人们在火药研制的基础上,创造了烟雾弹。烟雾弹燃烧时产生大量白烟,可以掩藏行踪。请写出一种可以作为烟雾弹主要成分的物质:________。 | |
| 21. 填空题 | 详细信息 |
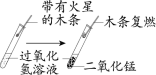
氢能被认为是21世纪最具发展潜力的清洁能源。 (1)电解水可以产生氢气,其反应的文字表达式为_____。图中有氢气产生的玻璃管是_____(填“a”或“b”),氢气燃烧时在火焰上方罩一个干冷小烧杯,可以看到的现象_____。 (2)2017年,世界首辆采用氢燃料电池有轨电车在我国唐山载客运营。该电车利用氢气和氧气在一定条件下发生反应为电车供能,产物生成水。该反应的文字表达式为_____。 |
|
| 22. 简答题 | 详细信息 |
|
空间站氧气的来源包括: (1)从地面携带液态氧存储罐。 (2)利用太阳能分解水。 (3)在紧急情况下,可使用“氧烛”来快速提供氧气。氧烛中含有氯酸钠(NaClO3)、金属粉末(Al、Fe、Mg等)和催化剂等。氧烛属于_____(物质分类)。氧烛放出的氧气来自于_____。推测氧烛中加入催化剂的作用是_____。 |
|
| 23. 填空题 | 详细信息 |
|
阅读下面科普短文(原文作者:杨骏等,有删改) 即使艳阳高照、天气晴好,有时人们也会出现眼睛刺痛、咳嗽等不良症状。专家认为,这很可能与臭氧(O3)有关。 臭氧原本是大气中自然产生的一种具有特殊臭味的微量气体。绝大部分臭氧存在于离地面25公里左右处的大气平流层中,这就是人们通常所说的臭氧层。臭氧量往往随纬度、季节和天气等因素的变化而不同。研究人员发现,天空中的臭氧层能吸收99%以上的太阳紫外线,为地球上的生物提供了天然的保护屏障。为何它又成了危害健康的污染物? 地表臭氧并非自然产生的,而是由石油产品(如汽油)等矿物燃料燃烧产生的氮氧化物(如二氧化氮)与空气中的氧气结合而形成的。强烈的阳光照射会加速这一化学反应。 地表空气中的臭氧对人体极为有害,一些易于过敏的人长时间暴露在臭氧含量超过每立方米180微克的环境中,会产生上述不良症状。研究表明,空气中每立方米臭氧含量增加100微克,人的呼吸功能就会减弱3%。对于运动员来说,空气中的臭氧含量可以直接影响到他们的耐力和比赛成绩。 自2013年中国执行新《环境空气质量标准》,监测6种污染物以来,臭氧便成为一些城市夏季空气质量“超标日”的首要污染物。下图为某地夏季某日昼时(7:00~18:00)臭氧、二氧化氮(NO2)浓度随时间的变化图。 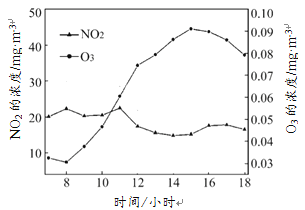 依据文章内容回答下列问题。 (1)请在方框中用图示表示1个臭氧分子的微观构成。  (2)地表空气中的臭氧是由 (填物质名称)直接转化生成的。 (3)如上图,某地夏季某日昼时,臭氧污染最严重的时间段是 (填序号)。 A.8:00~10:00 B.10:00~12:00 C.12:00~14:00 D.14:00~16:00 (4)下列说法正确的是 (填序号)。 A.臭氧是一种无色无味气体 B.臭氧层具有吸收紫外线的作用 C.地表空气中臭氧的含量与天气阴晴无关 D.空气中臭氧浓度不同会对人体造成不同程度的影响 (5)为了减少臭氧污染,请你向市民提出一条生活中可行的倡议 。 |
|
| 24. 流程题 | 详细信息 |
煤合成天然气(SNG)的工艺过程如图所示。 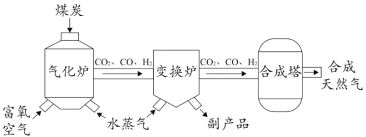 (1)气化炉中生成的单质是_____。 (2)在气化炉中,煤炭中的碳发生了多个反应。 ① 碳与氧气生成CO2反应的基本反应类型为_____。 ② 碳与水反应生成了CO,同时还有一种产物是_____。 (3)经变换炉反应后,产物中CO2和H2含量增加,CO含量降低,反应过程中化合价发生改变的元素有_____。 (4)合成天然气中的氢元素来自于原料中的_____。 |
|
| 25. 填空题 | 详细信息 |
实验室中用如图装置制取氧气。 (1)仪器 ①的名称是 。 (2)仪器①中盛装的药品是 ,反应的文字表达式是 。 (3)实验结束,停止加热前要先把导管移出水面;反之,则会导致水到吸入试管中。引起倒吸的原因是 。 |
|
| 26. 实验探究题 | 详细信息 |
|
化学兴趣小组利用课余时间自制氧气。有的同学从家里拿来了水杯(带盖子)用以收集氧气,有的同学从药店买了过氧化氢溶液。 (1)除了自带仪器外,还需向实验室借用的仪器有_____(填序号)。  (2)氧气验满的方法是_____。 (3)他们发现土豆块可以加快过氧化氢分解产生氧气的速率,其作用可能是_____,该反应的文字表达式是_____。 |
|
| 27. 简答题 | 详细信息 |
用下图所示装置测定空气中氧气的含量。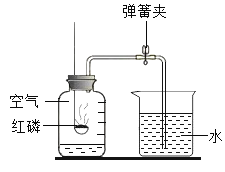 (1)实验前,需要进行的操作是_____。 (2)能说明空气中氧气含量的现象是_____。 (3)用红磷能测定空气中氧气含量的原因是_____。 |
|
| 28. 科学探究题 | 详细信息 | ||||||||
某化学小组同学研究铁丝在氧气中燃烧的反应,进行了如下实验。 (1)取一段打磨好的螺旋状铁丝,在下端系一根火柴,点燃火柴,待火柴快燃尽时,插入充满氧气且放有少量水的集气瓶,观察到如下现象:铁丝剧烈燃烧,放热,_____集气瓶底部出现黑色固体。 (2)为了确定该黑色固体的成分,同学们查阅到以下资料: ①铁粉是黑色或灰黑色粉末,四氧化三铁为黑色固体,具有磁性。 ②铁和盐酸反应:铁+盐酸→氯化亚铁+氨气 四氧化三铁和盐酸反应:四氧化三铁+盐酸→氯化铁+氯化亚铁+水 ③氯化亚铁溶液为浅绿色,氯化铁溶液为黄色 该小组同学根据以上资料,猜想黑色固体的成分有三种可能: a.只含有铁;b.只含有四氧化三铁;c._____ 经过讨论发现,猜想_____不合理,可以排除 (3)有同学提出:用磁铁来确定黑色固体的成分。其他同学表示反对,其理由为_____ (4)经过讨论,同学们设计了以下实验方案,通过实验确定了黑色固体的成分
|
|||||||||
| 29. 计算题 | 详细信息 | ||||||||||||||||
牛奶是我们日常生活中一种营养丰富的饮品,每天饮用可补充人们对钙等营养物质的需求。其中营养成分的具体含量如下表所示。  牛奶营养成分表 牛奶营养成分表
请根据资料回答下列问题: |
|||||||||||||||||
最近更新