文山州广南县第二中学2019年高二化学上期开学考试网上考试练习
| 1. 选择题 | 详细信息 |
|
将一定质量的金属钠放入100 mL 0.2 mol·L-1的氯化铝溶液中,反应后得到无色澄清溶液,其中除水外只含有氯化钠和偏铝酸钠,则加入的钠的质量为( ) A. 1.84 g B. 1.38 g C. 2.3 g D. 0.46 g |
|
| 2. 选择题 | 详细信息 |
|
把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( ) A. 0.1(b-2a)mol/L B. 10(2a-b)mol/L C. 10(b-a)mol/L D. 10(b-2a)mol/L |
|
| 3. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 纯铁为灰黑色,所以铁属于黑色金属 B. 铁在硫蒸气中燃烧生成Fe2S3 C. 纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化 D. 足量的铁在氯气中燃烧生成FeCl2和FeCl3 |
|
| 4. 选择题 | 详细信息 |
|
下列关于金属单质通性的说法不正确的是( ) A. 一般都具有金属光泽 B. 熔点都较高 C. 都是热和电的良导体 D. 都具有延展性 |
|
| 5. 选择题 | 详细信息 |
|
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( ) A. 原子半径:A>B>D>C B. 原子序数:d>c>b>a C. 离子半径:C>D>B>A D. 单质的还原性:A>B>D>C |
|
| 6. 选择题 | 详细信息 |
|
在实验桌上放着四种化学药品,试剂瓶上分别标有“白砂糖”、“小麦面粉”、“加碘食盐”和“食用味精”的字样。为了进一步确认实物与名称是否相符,下列做法中正确的是 ( ) A. 观察并比较它们的外观和状态 B. 各取少量,分别放在手中区别 C. 各取少量,分别放在嘴里品尝其味道 D. 各取少量,加水溶解,观察溶液颜色 |
|
| 7. 选择题 | 详细信息 |
|
化学变化一定存在:①状态和颜色的变化 ②发光放热 ③生成新物质 ④气体的放出 ⑤能量的变化( ) A. ③ B. ③⑤ C. ②④⑤ D. ①②③④ |
|
| 8. 选择题 | 详细信息 |
|
工业上用氢气和氮气合成氨,氢气的主要来源是( ) A. 水和燃煤 B. 电和水 C. 锌和硫酸反应 D. 液化空气 |
|
| 9. 选择题 | 详细信息 |
|
下列配制的溶液浓度偏高的是( ) A. 配制盐酸用量筒量取盐酸时俯视刻度线 B. 配制盐酸定容时,仰视容量瓶刻度线 C. 称量4.0gNaOH配制0.1 mol·L-1NaOH溶液1000mL时,砝码错放在左盘 D. NaOH溶解后未经冷却立即注入容量瓶至刻度线 |
|
| 10. 选择题 | 详细信息 |
|
防止煤矿矿井内“瓦斯”爆炸,除进行通风、严禁烟火外,还要随时检查矿井内瓦斯的体积分数。如果空气中含甲烷5%~15%,遇到明火会发生爆炸。发生最强烈爆炸时空气中甲烷所占的体积分数是( ) A. 5% B. 9.1% C. 10.5% D. 15% |
|
| 11. 选择题 | 详细信息 |
|
目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下: 以下推断不合理的是( ) A. 热空气能吹出溴是利用溴易挥发的性质 B. SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr C. 流程中循环利用的物质有SO2、Br2、Cl2等 D. 没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能 |
|
| 12. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 因为二氧化硫具有漂白性,所以它能使品红溶液、溴水、高锰酸钾溶液褪色 B. 能使品红溶液褪色的不一定是二氧化硫 C. 二氧化硫、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同 D. 等物质的量的二氧化硫和氯气相遇在溶液中具有漂白能力 |
|
| 13. 选择题 | 详细信息 |
|
某同学用托盘天平称量锌粒24.4g(1g以下用游码),他把锌粒放在右盘,砝码放在左盘,当天平平衡时,所称取的锌粒的实际质量应是:( ) A. 24.4g B. 25.5g C. 23.6g D. 24g |
|
| 14. 选择题 | 详细信息 |
|
常压下,苯的沸点低于甲苯,熔点却高于甲苯。苯的熔点更高的原因可能是 A. 苯具有芳香性 B. 苯中的化学键强度更强 C. 苯分子间作用力更小 D. 固态时苯分子排列更紧密 |
|
| 15. 选择题 | 详细信息 |
|
范德华力为a kJ·mol-1,化学键为b kJ·mol-1,氢键为c kJ·mol-1,则a、b、c的大小关系正确的是 A. a>b>c B. b>a>c C. c>b>a D. b>c>a |
|
| 16. 选择题 | 详细信息 |
|
农用化肥和城市生活污水的排放会使地下水含氮量增高,其对人体有害的含氮污染物存在的主要形式是( ) A. |
|
| 17. 选择题 | 详细信息 |
|
同温同压下,相同质量的二氧化硫气体和三氧化硫气体相比较:①它们所含分子数目之比为4∶5;②它们所含氧原子数目之比为5∶6;③它们所含原子总数之比为1∶1;④它们所含的硫原子数目之比为5∶4;⑤它们的密度之比为4∶5。上述有关叙述中正确是( ) A. ②③⑤ B. ①④⑤ C. ②④⑤ D. ①②⑤ |
|
| 18. 选择题 | 详细信息 |
|
下列物质中,不属于烷烃的是 A. CH4 B. C3H8 C. C4H8 D. C5H12 |
|
| 19. 选择题 | 详细信息 |
|
除去硝酸钾固体中含有少量的氯化钠,不需要的实验操作是 A. 加热溶解 B. 趁热过滤 C. 蒸发结晶 D. 降温结晶 |
|
| 20. 选择题 | 详细信息 |
|
等质量的CO和N2,下列叙述不正确的是( ) A. 密度一定相同 B. 分子数一定相同 C. 原子数一定相同 D. 物质的量一定相同 |
|
| 21. 选择题 | 详细信息 |
|
有关铝及其化合物的说法错误的是 A. 铁易生锈,而铝在空气中较稳定,所以铁比铝活泼 B. 可用铝壶烧开水,不可用其长期存放食醋、碱水 C. 氧化铝是一种较好的耐火材料,但不可用氧化铝坩埚熔化NaOH D. 氢氧化铝能中和胃酸,可用于制胃药 |
|
| 22. 选择题 | 详细信息 |
一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g) 下列说法不正确的是( ) A. 前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1 B. 达到平衡时,需要从外界吸收的能量为0.968 kJ C. 增大水的浓度,可以改变待反应的限度 D. 使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数 |
|
| 23. 选择题 | 详细信息 |
|
下列各组物质的性质及粒子的性质变化正确的是( ) A. 稳定性H2S>HCl>HBr>HI B. 还原性Na+>S2->Br->Cl- C. 微粒半径Cl->K+>S2->S D. 酸性HClO4>H2SO4>H2CO3>HClO |
|
| 24. 选择题 | 详细信息 |
|
已知某气体的摩尔质量为Mg/mol,则bg该气体在标准状况下的体积(L)为( ) A. 22.4Mb B. 22.4b/M C. 22.4M/b D. 22.4b |
|
| 25. 选择题 | 详细信息 |
|
下列哪种方法不能实现海水的淡化( ) A. 蒸馏法 B. 电渗析法 C. 离子交换法 D. 电解法 |
|
| 26. 选择题 | 详细信息 |
|
乙烯和乙醇的混合气体VL,完全燃烧后生成二氧化碳和水,消耗相同状态下的氧气3VL,则混合气体中乙烯和乙醇的体积比是( ) A. 1∶1 B. 2∶1 C. 1∶2 D. 任意比 |
|
| 27. 综合题 | 详细信息 |
|
利用分类法研究化学物质可系统、全面认识物质的性质。 Ⅰ.下列三组物质中,均有一种物质的类别与其他三种不同。 ①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2 (1)三种物质依次是(填化学式): ①________;②________;③________。 (2)这三种物质相互作用可生成一种新物质NaHCO3,该反应________(填“是”或“不是”)氧化还原反应。 (3)写出Na2CO3与足量稀硫酸反应的离子方程式:________________。 (4)HCO3-与H+、OH-在溶液都不能大量共存,试用离子方程式说明:_______________。 Ⅱ.现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体 (1)以上物质中能导电的是________。 (2)以上物质中属于电解质的是________,属于非电解质的是________。 (3)以上物质中,溶于水能导电的物质是________。 |
|
| 28. 综合题 | 详细信息 |
氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: (1)氢氧燃料电池能量转化的主要形式是____________________________________________,在导线中电子流动方向为________(用a、b表示)。 (2)负极反应式为________________________________________________________________。 (3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下: Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑ ①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。 ②金属锂吸收的氢气与放出的氢气的物质的量之比为________。 |
|
| 29. 综合题 | 详细信息 |
已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系: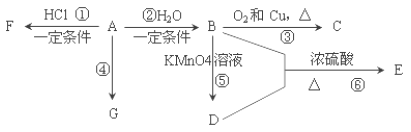 请回答下列问题: (1)A 的官能团的名称是___________; C 的结构简式是________; (2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________; (3)G 是一种高分子化合物,其结构简式是______________; (4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。 (5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。 |
|
| 30. 综合题 | 详细信息 |
“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺: 请回答下列问题: (1)工艺操作①、②分别为____________、____________。 (2)工业合成氨的化学方程式为:__________。 (3)写出生成“产品”的离子方程式:________。 (4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。 (5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。 |
|
| 31. 综合题 | 详细信息 |
某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下: 已知反应②:2I﹣+2Cu2++ 回答下列问题: (1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。 (2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。 (3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。 (4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。 (5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。 |
|
最近更新



