湖北省孝感市孝感高级中学2021届高三2月调研考试化学题带答案和解析
| 1. 选择题 | 详细信息 |
|
化学与生产和生活密切相关。下列有关说法正确的是( ) A.“梨花淡自棉深青,柳絮飞时花满城”中柳絮的主要成分和羽毛的相同 B.草莓棚中使用的“吊袋式二氧化碳气肥”的主要成分可以是碳酸钙 C.酿酒过程中葡萄糖在酒化酶的作用下发生水解反应生成乙醇 D.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯是有机高分子化合物 |
|
| 2. 选择题 | 详细信息 |
为解决污染、变废为宝,我国科研人员研究在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。 下列说法中,错误的是 A.最终产物X、Y属于同系物 B.产物X名称为“2-甲基丁烷”或“异戊烷” C.反应I、II、III均有副产物H2O产生 D.产物X、Y的核磁共振氢谱图上均有4组峰 |
|
| 3. 选择题 | 详细信息 |
某矿石的成分为: 已知Co的金属性大于Cu、小于Fe,下列说法正确的是 A.“生物浸出”在较高温度下进行可以提高浸出率 B.萃取振荡时,分液漏斗下口应倾斜向上 C.分液时,应将上层液体由分液漏斗下口放至另一烧杯中 D.用KSCN溶液和新制氯水可以检验“水相”中的Fe2+ |
|
| 4. 选择题 | 详细信息 |
|
一定温度下,下列溶液的离子浓度关系式正确的是( ) A.pH=5 的H2S 溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 B.pH=a 的氨水溶液,稀释 10 倍后,其pH=b,则a=b+1 C.pH=2 的H2C2O4 溶液与 pH=12 的 NaOH 溶液任意比例混合: D.已知 CH3COOH、H2CO3、HClO 的电离常数分别为 |
|
| 5. 选择题 | 详细信息 | |||||||||||||||
关于下列消毒剂的有效成分的分析错误的是
|
||||||||||||||||
| 6. 选择题 | 详细信息 |
一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( ) A.WX是共价化合物 B.该物质中所有原子都满足8e-结构 C.该物质中两个Y原子的杂化方式相同 D.电负性顺序为Z>Q>Y>X |
|
| 7. 选择题 | 详细信息 |
三甲胺 [N(CH3)3]是一种一元有机弱碱,可简写为MOH。常温下,向20mL 0.5mol/L MOH溶液中逐滴加入浓度为0.25mol/L的HCl溶液,溶液中lg 、pOH[pOH=-lgc(OH-)]、中和率( 、pOH[pOH=-lgc(OH-)]、中和率(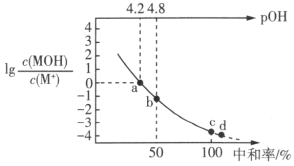 A.三甲胺[N(CH3)3]的电离常数为10-4.8 B.a点时,c(MOH)+c(M+)=2c(Cl-) C.b点时,c(M+)>c(Cl-)>c(MOH)>c(OH-)>c(H+) D.溶液中水的电离程度:c点<d点 |
|
| 8. 选择题 | 详细信息 |
我国学者结合实验与计算机模拟结果,研究了丙烷在六方氮化硼催化剂表面氧化脱氢制丙烯的反应历程,部分历程如图所示,其中吸附在催化剂表面的物种用*标注。下列说法错误的是( )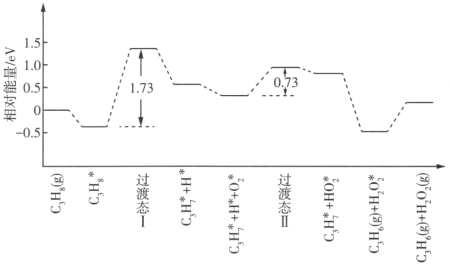 A.丙烷在镍催化剂表面氧化脱氢制丙烯的反应历程与上述不同 B.反应历程中决速步骤能垒(活化能)为 C.反应历程中,生成过渡态Ⅰ比生成过渡态Ⅱ容易 D.图示反应历程之后可能发生的化学反应为 |
|
| 9. 选择题 | 详细信息 |
大气中氮氧化物和碳氢化合物受紫外线作用可产生一次污染物——光化学烟雾,其中部分物质的反应过程如图所示.下列说正确的是 A.该过程中O2作催化剂 B.反应过程中没有电子转移 C.反应过程中氮氧化物不断被消耗 D.丙烯被氧化为甲醛和乙醛 |
|
| 10. 选择题 | 详细信息 |
锂离子电池的正极材料为LiMn2O4、碳粉及铝箔,某小组设计下列室温下的流程处理废旧锂离子电池的正极材料,下列离子反应方程式书写错误的是 A.加入过量NaOH溶液: B.LiMn2O4被氧化: C.滤液Ⅱ加入饱和碳酸钠溶液: D.滤液I加入过量CO2: |
|
| 11. 选择题 | 详细信息 |
已知:普通铁+水蒸气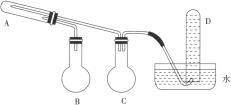  关于上述装置和实验,下列分析错误的是( ) A.A、I中加入普通铁粉,G中可加人碱石灰 B.A中生成磁性氧化铁,E中生成“引火铁 C.需要加热的仪器只有A、E D.D用于收集氢气,F处的尾气需处理 |
|
| 12. 选择题 | 详细信息 |
常温下,将NaOH溶液滴加到20 mL等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:p A.m点对应的NaOH溶液体积小于10 mL B.Ka(HA)的数量级为10-5 C.l点所示溶液中:c(Na+)<c(A-)+c(HA) D.各点水的电离程度关系:n>m>l |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)
|
|||||||||||||||||
| 14. 选择题 | 详细信息 |
NaAlH4晶胞结构如图所示,它由两个正六面体叠加而成,已知正六面体的棱长a nm。下列说法错误的是( ) A.NaAlH4晶体中,与AlH B.设阿伏伽德罗常数的值为NA,则晶体的密度为 C.制备NaAlH4的反应选择在乙醚(CH3CH2OCH2CH3)中进行,也可以是水或乙醇 D.AlH |
|
| 15. 选择题 | 详细信息 |
研究人员开发了一种新型的硼、氮共掺杂的多孔石墨烯材料作为正极催化剂的锂-二氧化碳二次电池,实现了碳酸锂在电池中的高度可逆分解,其装置示意图如图所示。下列说法错误的是( )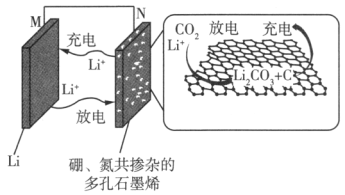 A.放电时,N极发生还原反应 B.充电时,M极与电源正极相连 C.放电时,正极反应式为 D.电解液不可选用水溶液 |
|
| 16. 实验题 | 详细信息 |
硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示: 已知:①NH3不溶于CS2,CS2密度比水大且不溶于水; ②三颈烧瓶内盛放:CS2、水和催化剂。 ③CS2+3NH3 回答下列问题: (1)装置A中反应的化学方程式是___。 (2)装置C的作用是__。 (3)制备KSCN溶液:熄灭A处的酒精灯,关闭K1,保持三颈烧瓶内液温105℃一段时间,然后打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,写出装置D中生成KSCN的化学方程式:___。 (4)装置E的作用为吸收尾气,防止污染环境,写出吸收NH3时的离子方程式___。 (5)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压__、__、过滤、洗涤、干燥,得到硫氰化钾晶体。 (6)测定晶体中KSCN的含量:称取10.0g样品。配成1000mL溶液量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液18.00mL。[已知:滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色)。] ①滴定过程的指示剂a为___。 ②晶体中KSCN的质量分数为___。 |
|
| 17. | 详细信息 |
 (庚)是合成某些高分子材料和药物的重要中间体。某实验室以澳代甲基环已烷为原料合成有机物庚,合成路线如下: (庚)是合成某些高分子材料和药物的重要中间体。某实验室以澳代甲基环已烷为原料合成有机物庚,合成路线如下: 回答下列问题: (1)乙的结构简式为_________。 (2)写出丙转化成丁的化学方程式_______。 (3)戊分子中含有的官能团名称是_____。 (4)己转化成丁的反应类型是______。 (5)已知当醇中— ①在稀硫酸、加热条件下能够水解 ②能和新制 ③能与灼热 ④分子中含有五元环 其中,核磁共振氧谱中有四组峰,且峰面积之比是4:4:2:1:1的物质的结构简式为______。 (6)结合以上合成路线,设计以丙炔和1,3-丁二烯为基本原料合成2-羟基丁酸(  |
|
| 18. | 详细信息 | ||||||||
|
沼气的主要成分是CH4,还含有CO2,H2S等。 (1)工业上可用甲烷裂解法制取乙炔,反应为2CH4(g)
(2)硫化氢加热时可发生反应2H2S(g) |
|||||||||
| 19. | 详细信息 |
钯(Pd)是一种不活泼金属,含钯催化剂在工业、科研上用量较大。某废钯催化剂(钯碳)中含有钯(5%~6%)、碳(93%~94%)、铁(1%~2%)以及其他杂质,故钯碳具有很高的回收价值。如图是利用钯碳制备氯化钯(PdCl2)和Pd的流程: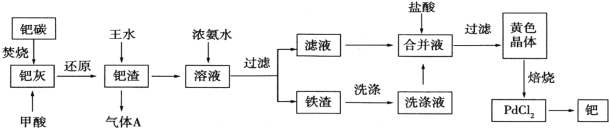 回答下列问题: (1)“钯碳”焚烧过程中空气一定要过量,目的是___。 (2)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式__。 (3)王水是按照体积比3:1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,请写出Pd和王水反应的化学方程式______。 (4)加入浓氨水,调节pH至9.0,并控制温度在70~75℃,Pd元素以[Pd(NH3)4]2+的形式存在于溶液中。若温度大于75℃,则不利于除铁,原因是______;“铁渣”的主要成分是絮状的Fe(OH)3需要在一定温度下洗涤,并将洗涤液和滤液合并,目的是____。 (5)黄色晶体的成分为[Pd(NH3)2]Cl2,将其烘干、在空气中550℃下焙烧(氧气不参与反应)可以直接得到Pd,同时得到无色刺激性混合气体,在温度下降时“冒白烟”,则除Pd外其它产物有_____(写化学式)。 (6)海绵状金属钯密度为12.0 g•cm-3,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=__mL•g-1。 |
|
最近更新







