2017-2018е№ҙй«ҳдёҖдёҠеҶҢеҢ–еӯҰжңҹжң«иҖғиҜ•дё“йўҳи®ӯз»ғпјҲж№–еҢ—зңҒй•ҝйҳідёӯеӯҰпјү
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢж“ҚдҪңдёӯй”ҷиҜҜзҡ„жҳҜпјҲ пјү A.и’ёеҸ‘ж“ҚдҪңж—¶пјҢеҪ“жңүеӨ§йҮҸжҷ¶дҪ“жһҗеҮәж—¶еҒңжӯўеҠ зғӯпјҢз”ЁдҪҷзғӯдҪҝж°ҙи’ёеҸ‘гҖӮ B.и’ёйҰҸж“ҚдҪңж—¶пјҢеә”дҪҝжё©еәҰи®Ўж°ҙ银зҗғйқ иҝ‘и’ёйҰҸзғ§з“¶зҡ„ж”Ҝз®ЎеҸЈеӨ„ C.еҲҶж¶Іж“ҚдҪңж—¶пјҢеҲҶж¶ІжјҸж–—дёӯдёӢеұӮж¶ІдҪ“д»ҺдёӢеҸЈж”ҫеҮәпјҢдёҠеұӮж¶ІдҪ“д»ҺдёҠеҸЈеҖ’еҮә D.иҗғеҸ–ж“ҚдҪңж—¶пјҢеә”йҖүжӢ©жңүжңәиҗғеҸ–еүӮпјҢдё”иҗғеҸ–еүӮзҡ„еҜҶеәҰеҝ…йЎ»жҜ”ж°ҙеӨ§ |
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еҗҲзү©дёӯпјҢдёҚиғҪйҖҡиҝҮеҢ–еҗҲеҸҚеә”еҲ¶еҸ–зҡ„жҳҜпјҡпјҲ пјү A.FeCl3 B.H2SiO3 C.CuCl2 D.FeCl2 |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°Ҝж°”жҳҜдёҖз§ҚеҢ–еӯҰжҖ§иҙЁеҫҲжҙ»жіјзҡ„йқһйҮ‘еұһеҚ•иҙЁпјҢе®ғе…·жңүиҫғејәзҡ„ж°§еҢ–жҖ§гҖӮдёӢеҲ—еҸҷиҝ°дёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҡпјҲ пјү A.зәўзғӯзҡ„й“ңдёқеңЁж°Ҝж°”дёӯеү§зғҲзҮғзғ§пјҢз”ҹжҲҗжЈ•й»„иүІзғҹ B.й’ еңЁж°Ҝж°”дёӯзҮғзғ§пјҢз”ҹжҲҗзҷҪиүІзҡ„зғҹ C.зәҜеҮҖзҡ„ж°ўж°”еңЁж°Ҝж°”дёӯе®үйқҷзҡ„зҮғзғ§пјҢеңЁйӣҶ气瓶еҸЈеҪўжҲҗзҷҪиүІзғҹйӣҫ D.ж°Ҝж°”иғҪдёҺж°ҙеҸҚеә”з”ҹжҲҗзӣҗй…ёе’Ңж¬Ўж°Ҝй…ёпјҢж¬Ўж°Ҝй…ёи§Ғе…үжҳ“еҲҶи§Ј |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺFe(OH)3иғ¶дҪ“зҡ„иҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҡпјҲ пјү A.Fe(OH)3иғ¶дҪ“дёҺйЈҹзӣҗжә¶ж¶Іж··еҗҲе°Ҷдә§з”ҹиҒҡжІүзҺ°иұЎ B.Fe(OH)3иғ¶дҪ“зІ’еӯҗеңЁз”өеңәеҪұе“ҚдёӢе°Ҷеҗ‘йҳіжһҒ移еҠЁ C.иғ¶дҪ“дёӯFe(OH)3иғ¶дҪ“зІ’еӯҗдёҚеҒңең°дҪңеёғжң—иҝҗеҠЁ D.е…үзәҝйҖҡиҝҮFe(OH)3иғ¶дҪ“ж—¶дјҡеҸ‘з”ҹдёҒиҫҫе°”ж•Ҳеә” |
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҡпјҲ пјү A.3.01Г—1023дёӘж°®еҲҶеӯҗдёӯеҗ«жңүзҡ„еҺҹеӯҗж•°дёәNA B.1molH2OеҲҶеӯҗзҡ„иҙЁйҮҸдёҺNAдёӘH2OеҲҶеӯҗзҡ„иҙЁйҮҸзӣёзӯү C.ж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4 Lж°Ёж°ҙеҗ«жңүNAдёӘNH3еҲҶеӯҗ D.1molOHпјҚеҗ«10NAдёӘз”өеӯҗ |
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дјҰж•ҰеҘҘиҝҗдјҡй—ӯ幕ејҸдёҠпјҢзҮғж”ҫдәҶеӨ§йҮҸзҡ„зғҹиҠұпјҢдә”еҪ©зјӨзә·зҡ„з„°зҒ«еҚҒеҲҶеҘҪзңӢгҖӮз ”з©¶иЎЁжҳҺпјҢз„°зҒ«йўңиүІзҡ„дә§з”ҹдёҺзғҹиҠұдёӯеҗ«жңүй’ гҖҒй’ҫгҖҒй’ҷгҖҒй’ЎгҖҒй“ңгҖҒ锶зӯүйҮ‘еұһе…ғзҙ жңүе…ігҖӮдёӢеҲ—жңүе…іиҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҡпјҲ пјү A.дә”еҪ©зјӨзә·зҡ„з„°зҒ«зҡ„еҪўжҲҗжҳҜеӣ дёәдёҠиҝ°йҮ‘еұһе…ғзҙ еҸ‘з”ҹдәҶз„°иүІеҸҚеә” B.й’ еҸҜд»ҘдҝқеӯҳеңЁз…ӨжІ№дёӯ C.KClдёҺKNO3зҒјзғ§ж—¶зҒ«з„°зҡ„йўңиүІдёҚзӣёеҗҢ D.и§ӮеҜҹй’ҫеҸҠе…¶еҢ–еҗҲзү©зҡ„з„°иүІеҸҚеә”йңҖиҰҒйҖҸиҝҮи“қиүІй’ҙзҺ»з’ғ |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯеұһдәҺзәҜеҮҖзү©зҡ„жҳҜпјҡпјҲ пјү A.ж¶Іж°Ҝ B.жјӮзҷҪзІү C.ж°Ҝж°ҙ D.зӣҗй…ё |
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҫ®зІ’дёҚе…·жңүиҝҳеҺҹжҖ§зҡ„жҳҜпјҡпјҲ пјү A.H2 B.H+ C.Cl2 D.Cl- |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶдёҖеқ—й“қз®”з”Ёз Ӯзәёжү“зЈЁиЎЁйқўеҗҺпјҢеңЁй…’зІҫзҒҜдёҠеҠ зғӯиҮізҶ”еҢ–пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҡпјҲ пјү A.зҶ”еҢ–зҡ„жҳҜй“қ B.зҶ”еҢ–зҡ„жҳҜAl2O3 C.зҶ”еҢ–зү©иҝ…йҖҹзҮғзғ§ D.зҶ”еҢ–зү©иҝ…йҖҹж»ҙиҗҪдёӢжқҘ |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢж“ҚдҪңдёҺе®үе…ЁдәӢж•…еӨ„зҗҶдёҚжӯЈзЎ®зҡ„жҳҜпјҡпјҲ пјү A.з”ЁиҜ•з®ЎеӨ№д»ҺиҜ•з®Ўеә•йғЁз”ұдёӢеҫҖдёҠеӨ№дҪҸи·қиҜ•з®ЎеҸЈзәҰ1/3еӨ„пјҢжүӢжҢҒиҜ•з®ЎеӨ№й•ҝжҹ„жң«з«ҜпјҢиҝӣиЎҢеҠ зғӯ B.е°ҶCOдёӯжҜ’иҖ…移еҠЁеҲ°йҖҡйЈҺеӨ„жҠўж•‘ C.дёҚж…Һе°Ҷжө“H2SO4жә…еҲ°зҡ®иӮӨдёҠпјҢеә”з«ӢеҚіз”ЁNaOHзЁҖжә¶ж¶ІиҝӣиЎҢеҶІжҙ— D.зңјзқӣйҮҢдёҚж…Һжә…е…ҘиҚҜж¶ІпјҢеә”з«ӢеҚіз”Ёж°ҙеҶІжҙ—пјҢиҫ№жҙ—иҫ№зңЁзңјпјҢдёҚеҸҜз”ЁжүӢжҸүзңјзқӣ |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҡпјҲ пјү A.еҗ‘NaHCO3жә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶ІпјҡH++OH-?H2O B.иҝҮж°§еҢ–й’ еҠ е…Ҙж°ҙдёӯпјҡ2O22-+2H2O?4OH-+O2вҶ‘ C.еҗ‘AlCl3жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙпјҡAl3++3NH3?H2O?Al(OH)3вҶ“+3NH4+ D.зЎ«й…ёй“ңжә¶ж¶Ідёӯж»ҙеҠ ж°ўж°§еҢ–й’Ўжә¶ж¶ІBa2+ +SO42-?BaSO4вҶ“ |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰеҸҳеҢ–дёӯпјҢйңҖеҠ е…Ҙж°§еҢ–еүӮжүҚиғҪе®һзҺ°зҡ„жҳҜпјҡпјҲ пјү A.(NH4)2SO4вҶ’ NH3 B.C вҶ’ CO2 C.Cl2 вҶ’ HClO D.HClвҶ’ AgCl |
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁжҖ§иҙЁе’Ңеә”з”Ёзҡ„еҜ№еә”е…ізі»жӯЈзЎ®зҡ„жҳҜпјҡпјҲ пјү A.84ж¶ҲжҜ’ж¶Іе…·жңүзўұжҖ§пјҢеҸҜз”ЁдҪңж¶ҲжҜ’еүӮе’ҢжјӮзҷҪеүӮ B.ж°ўж°ҹй…ёе…·жңүй…ёжҖ§пјҢеҸҜз”ЁдәҺзҺ»з’ғзҡ„и…җиҡҖеүӮ C.иҝҮж°§еҢ–й’ е…·жңүжјӮзҷҪжҖ§пјҢеҸҜдҪңиҲӘз©әе’ҢжҪңж°ҙзҡ„дҫӣж°§еүӮ D.жҙ»жҖ§й“ҒзІүе…·жңүиҝҳеҺҹжҖ§пјҢеңЁйЈҹе“ҒиўӢдёӯеҸҜз”ЁдҪңйҷӨж°§еүӮ |
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁејәй…ёжҖ§жә¶ж¶ІдёӯеҸҜд»ҘеӨ§йҮҸе…ұеӯҳпјҢдё”жә¶ж¶Іж— иүІйҖҸжҳҺзҡ„жҳҜпјҡпјҲ пјү A.CO32пјҚгҖҒNaпјӢгҖҒCa2пјӢгҖҒClпјҚ B.MnO4пјҚгҖҒHпјӢгҖҒKпјӢгҖҒSO42пјҚ C.Fe2+гҖҒK+гҖҒNO3пјҚгҖҒClпјҚ D.NO3пјҚгҖҒSO42пјҚгҖҒKпјӢгҖҒHпјӢ |
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
дёӢеҲ—иЈ…зҪ®еә”з”ЁдәҺе®һйӘҢе®ӨеҲ¶ж°Ҝ气并еӣһ收ж°ҜеҢ–й”°зҡ„е®һйӘҢпјҢе·ІзҹҘж°ҜеҢ–й”°еҸҜжә¶дәҺж°ҙпјҢдәҢж°§еҢ–й”°йҡҫжә¶дәҺж°ҙпјҢиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜпјҡпјҲ пјү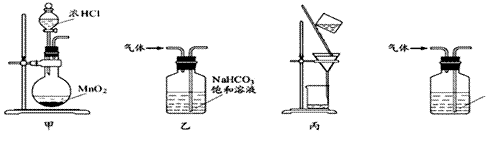 A.з”ЁиЈ…зҪ®з”ІеҲ¶еҸ–ж°Ҝж°” B.з”ЁиЈ…зҪ®д№ҷеҗёж”¶е®һйӘҢиҝҮзЁӢдёӯеҲ¶еҸ–зҡ„еӨҡдҪҷзҡ„ж°Ҝж°” C.з”ЁиЈ…зҪ®дёҷеҲҶзҰ»дәҢж°§еҢ–й”°е’Ңж°ҜеҢ–й”°жә¶ж¶І D.з”ЁиЈ…зҪ®дёҒйҷӨеҺ»ж°Ҝж°”дёӯзҡ„е°‘йҮҸж°ҜеҢ–ж°ў |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗҢжё©еҗҢеҺӢпјҢзӣёеҗҢдҪ“з§Ҝзҡ„COе’ҢC2H4е…·жңүзӣёеҗҢзҡ„пјҡпјҲ пјү в‘ еҲҶеӯҗж•° в‘ЎеҺҹеӯҗжҖ»ж•° в‘ўзўіеҺҹеӯҗж•° в‘ЈиҙЁйҮҸ A.в‘ в‘Ўв‘ўв‘Ј B.в‘Ўв‘ўв‘Ј C.в‘ в‘Ўв‘ў D.в‘ в‘Ј |
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
иҰҒиҜҒжҳҺжҹҗжә¶ж¶ІдёӯдёҚеҗ«Fe3+иҖҢеҸҜиғҪеҗ«жңүFe2+иҝӣиЎҢеҰӮдёӢе®һйӘҢж“ҚдҪңж—¶пјҢжңҖдҪійЎәеәҸдёәпјҲ пјү в‘ еҠ е…Ҙи¶ійҮҸж°Ҝж°ҙ в‘ЎеҠ е…Ҙи¶ійҮҸKMnO4жә¶ж¶І в‘ўеҠ е…Ҙе°‘йҮҸNH4SCNжә¶ж¶ІпјҺ A.в‘ в‘ў B.в‘ўв‘Ў C.в‘ўв‘ D.в‘ в‘Ўв‘ў |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зү©иҙЁжңүе…іжҖ§иҙЁзҡ„жҜ”иҫғдёӯпјҢжӯЈзЎ®зҡ„жҳҜпјҡпјҲ пјү A.зғӯзЁіе®ҡжҖ§пјҡNaHCO3 > Na2CO3 B.й…ёжҖ§пјҡH2SiO3 > H2CO3 C.зҶ”зӮ№пјҡSiO2 > CO2пјҲе№ІеҶ°пјү D.зЎ¬еәҰпјҡSiO2 < CO2пјҲе№ІеҶ°пјү |
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
ж №жҚ®еҸҚеә”в‘ 2FeCl3пјӢ2KI=2FeCl2пјӢ2KClпјӢI2 пјҢ в‘Ў2FeCl2пјӢCl2пјқ2FeCl3 пјҢ еҲӨж–ӯдёӢеҲ—зү©иҙЁзҡ„ж°§еҢ–жҖ§з”ұејәеҲ°ејұзҡ„йЎәеәҸдёӯпјҢжӯЈзЎ®зҡ„жҳҜ( ) A.Fe3пјӢ>Cl2>I2 B.Cl2>I2>Fe3пјӢ C.I2>Cl2>Fe3пјӢ D.Cl2>Fe3пјӢ>I2 |
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁAl2 (SO4 )3 гҖҒK2 SO4 е’ҢжҳҺзҹҫзҡ„ж··еҗҲжә¶ж¶Ідёӯ,еҰӮжһңc(SO4 2- )зӯүдәҺ0.2 mol/L,еҪ“еҠ е…ҘзӯүдҪ“з§Ҝзҡ„0.2 mol/L зҡ„KOHжә¶ж¶Іж—¶,з”ҹжҲҗзҡ„жІүж·ҖжҒ°еҘҪжә¶и§Ј,еҲҷеҺҹж··еҗҲжә¶ж¶ІдёӯK + зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәпјҲ пјү A.0.2 mol/L B.0.25 mol/L C.0.45 mol/L D.0.225 mol/L |
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
зҒ«иҚҜжҳҜдёӯеӣҪзҡ„вҖңеӣӣеӨ§еҸ‘жҳҺвҖқд№ӢдёҖпјҢж°ёиҝңеҖјеҫ—зӮҺй»„еӯҗеӯҷйӘ„еӮІпјҢд№ҹж°ёиҝңдјҡжҝҖеҠұзқҖжҲ‘们еҺ»еҘӢеҸ‘еӣҫејәгҖӮй»‘зҒ«иҚҜеңЁеҸ‘з”ҹзҲҶзӮёж—¶пјҢеҸ‘з”ҹеҰӮдёӢзҡ„еҸҚеә”пјҡ2KNO3+3CпјӢS=K2S+N2вҶ‘+3CO2вҶ‘гҖӮ пјҲ1пјүе…¶дёӯиў«иҝҳеҺҹзҡ„е…ғзҙ жҳҜ пјҢ иў«ж°§еҢ–зҡ„е…ғзҙ жҳҜ пјҢ ж°§еҢ–еүӮжҳҜ пјҢ иҝҳеҺҹеүӮжҳҜ пјҢ ж°§еҢ–дә§зү©жҳҜ пјҢ иҝҳеҺҹдә§зү©жҳҜ гҖӮ пјҲ2пјүз”ЁеҸҢзәҝжЎҘж ҮеҮәз”өеӯҗиҪ¬з§»зҡ„ж–№еҗ‘е’Ңж•°зӣ®пјҡ2KNO3+ 3CпјӢ S ? K2S + N2вҶ‘+ 3CO2вҶ‘ гҖӮ пјҲ3пјүеҪ“0.1molCO2з”ҹжҲҗж—¶пјҢеҲҷиҪ¬з§»зҡ„з”өеӯҗж•°дёә дёӘгҖӮ |
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёӢеҲ—зү©иҙЁпјҡв‘ ж°ўж°§еҢ–й’ еӣәдҪ“гҖҖв‘Ўй“ңдёқгҖҖв‘ўж°ҜеҢ–ж°ўж°”дҪ“гҖҖв‘ЈзЁҖзЎ«й…ёгҖҖв‘ӨдәҢж°§еҢ–зўіж°”дҪ“гҖҖв‘Ҙж°Ёж°ҙгҖҖв‘Ұзўій…ёй’ зІүжң«гҖҖ⑧蔗糖жҷ¶дҪ“гҖҖв‘ЁзҶ”иһҚж°ҜеҢ–й’ гҖҖв‘©CuSO4?5H2Oжҷ¶дҪ“гҖӮиҜ·з”ЁеәҸеҸ·еЎ«з©әпјҡ пјҲ1пјүдёҠиҝ°зҠ¶жҖҒдёӢеҸҜеҜјз”өзҡ„жҳҜ гҖӮ пјҲ2пјүеұһдәҺз”өи§ЈиҙЁзҡ„жҳҜ гҖӮ пјҲ3пјүеұһдәҺйқһз”өи§ЈиҙЁзҡ„жҳҜ гҖӮ пјҲ4пјүдёҠиҝ°зҠ¶жҖҒдёӢзҡ„з”өи§ЈиҙЁдёҚиғҪеҜјз”өзҡ„жҳҜ гҖӮ |
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж¬Ўе®һйӘҢйңҖз”Ё80mLгҖҒ3mol/L зҡ„зЁҖH2SO4жә¶ж¶ІпјҢжҹҗеҗҢеӯҰз”Ё98%зҡ„жө“H2SO4пјҲПҒ=1.84g/cm3пјүиҝӣиЎҢй…ҚеҲ¶пјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјү98%зҡ„жө“H2SO4пјҲПҒ=1.84g/cm3пјүзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә пјҢ йңҖиҰҒ80mLгҖҒ3mol/L зҡ„зЁҖH2SO4жә¶ж¶ІпјҢеҲҷйңҖеҸ– mL(дҝқз•ҷдёҖдҪҚжңүж•Ҳж•°еӯ—)зҡ„иҜҘзЎ«й…ёпјҢйҮҸеҸ–жө“зЎ«й…ёжүҖз”Ёзҡ„йҮҸзӯ’зҡ„и§„ж јжҳҜ пјҲд»ҺдёӢеҲ—дёӯйҖүз”Ёпјү AпјҺ10mL BпјҺ25mL CпјҺ50mL DпјҺ100mL пјҲ2пјүе°ҶдёӢеҲ—жӯҘйӘӨдёӯзҡ„з©әж јеҶ…жүҖз”Ёд»ӘеҷЁиЎҘе……еЎ«еҶҷе®Ңж•ҙ в‘ з”ЁйҮҸзӯ’йҮҸеҸ–жүҖйңҖзҡ„жө“зЎ«й…ё в‘Ўе°Ҷзғ§жқҜдёӯзҡ„жә¶ж¶ІиҪ¬з§»еҲ° mLзҡ„е®№йҮҸ瓶дёӯ в‘ўе°Ҷжө“зЎ«й…ёзј“зј“жіЁе…ҘзӣӣжңүйҖӮйҮҸи’ёйҰҸж°ҙзҡ„зғ§жқҜдёӯпјҢиҫ№еҠ иҫ№жҗ…жӢҢ в‘Је°Ҷжә¶ж¶ІеҶ·еҚҙпјҢжҒўеӨҚиҮіе®Өжё© в‘Өеҗ‘е®№йҮҸ瓶дёӯеҠ е…Ҙи’ёйҰҸж°ҙпјҢеңЁи·қзҰ»еҲ»еәҰ1пҪһ2cmж—¶пјҢж”№з”Ё еҠ и’ёйҰҸж°ҙиҮіеҲ»еәҰзәҝ в‘Ҙзӣ–еҘҪ瓶еЎһпјҢеҸҚеӨҚдёҠдёӢйў еҖ’пјҢж‘ҮеҢҖ в‘Ұжҙ—ж¶Өзғ§жқҜ2пҪһ3ж¬ЎпјҢжҙ—ж¶Өж¶Ід№ҹжіЁе…Ҙе®№йҮҸ瓶дёӯпјҺиҪ»иҪ»ж‘ҮеҠЁе®№йҮҸ瓶пјҢдҪҝжә¶ж¶Іж··еҗҲеқҮеҢҖпјҺ пјҲ3пјүе®һйӘҢдёӯдёҠиҝ°жӯҘйӘӨзҡ„жӯЈзЎ®йЎәеәҸдёә пјҲеЎ«еәҸеҸ·пјү пјҲ4пјүдёӢеҲ—еҗ„з§Қжғ…еҶөеҜ№жүҖй…ҚеҲ¶жә¶ж¶Іжө“еәҰжңүдҪ•еҪұе“ҚпјҲйҖүеЎ«вҖңеҒҸй«ҳвҖқгҖҒвҖңеҒҸдҪҺвҖқжҲ–вҖңж— еҪұе“ҚвҖқпјү AпјҺжүҖз”Ёзҡ„жө“зЎ«й…ёй•ҝж—¶й—ҙж”ҫзҪ®еңЁеҜҶе°ҒдёҚеҘҪзҡ„е®№еҷЁдёӯ пјҺ BпјҺжңӘз»ҸеҶ·еҚҙи¶Ғзғӯе°Ҷжә¶ж¶ІжіЁе…Ҙе®№йҮҸ瓶дёӯпјҡ пјҺ CпјҺжүҖз”ЁиҝҮзҡ„зғ§жқҜгҖҒзҺ»з’ғжЈ’жңӘжҙ—ж¶Ө пјҺ DпјҺе®ҡе®№ж—¶дҝҜи§Ҷж¶ІйқўиҜ»ж•°пјҡ пјҺ пјҲ5пјүеҸ–з”Ёд»»ж„ҸдҪ“з§Ҝзҡ„жүҖй…Қ3mol/LзЎ«й…ёжә¶ж¶Іж—¶пјҢдёӢеҲ—зү©зҗҶйҮҸдёӯдёҚйҡҸжүҖеҸ–дҪ“з§Ҝзҡ„еӨҡе°‘иҖҢеҸҳеҢ–зҡ„жҳҜ_______пјҲеЎ«еӯ—жҜҚпјү A.жә¶ж¶ІдёӯH2SO4зҡ„зү©иҙЁзҡ„йҮҸ B.жә¶ж¶Ізҡ„жө“еәҰ C.жә¶ж¶ІдёӯSO42?зҡ„ж•°зӣ® D.жә¶ж¶Ізҡ„еҜҶеәҰ |
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFе…ӯз§Қзү©иҙЁжңүеҰӮдёӢеҸҳеҢ–е…ізі»пјҢEжҳҜж·Ўй»„иүІзІүжң«пјҢеҲӨж–ӯпјҡ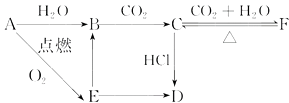 пјҲ1пјүеҶҷеҮәAгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFзҡ„еҢ–еӯҰејҸпјҡ AпјҺ пјӣBпјҺ пјӣCпјҺ пјӣ DпјҺ пјӣEпјҺ пјӣFпјҺ гҖӮ пјҲ2пјүеҶҷеҮәжңүе…іеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ(жҳҜзҰ»еӯҗеҸҚеә”зҡ„зӣҙжҺҘеҶҷеҮәзҰ»еӯҗж–№зЁӢејҸ) B вҶ’ Cпјҡ пјҢ E вҶ’ Bпјҡ пјҢ C вҶ’ Fпјҡ пјҢ F вҶ’ Cпјҡ гҖӮ |
|
й«ҳдёӯеҢ–еӯҰ иҜ•еҚ·жҺЁиҚҗ
- 2019еұҠй«ҳдёүдёӢжңҹ第дёғж¬ЎжЁЎжӢҹиҖғиҜ•зҗҶ科综еҗҲеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲиҙөе·һзңҒйҒөд№үеёӮиҲӘеӨ©й«ҳзә§дёӯеӯҰпјү
- й«ҳдёҖеҝ…дҝ®з¬¬дёҖеҶҢ第1з« з¬¬1иҠӮ иө°иҝӣеҢ–еӯҰ科еӯҰ
- 2019-2020е№ҙй«ҳдёҖдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғйўҳпјҲеӣӣе·қзңҒжіёеҺҝ第дә”дёӯеӯҰпјү
- еҶ…и’ҷеҸӨ2019е№ҙй«ҳдәҢеҢ–еӯҰдёҠеӯҰжңҹжңҲиҖғжөӢйӘҢиҜ•еҚ·е®Ңж•ҙзүҲ
- йқ’еІӣеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·йўҳе…Қиҙ№иҜ•еҚ·
- жөҷжұҹй«ҳдёҖеҢ–еӯҰжңҹжң«иҖғиҜ•пјҲ2020е№ҙеүҚеҚҠжңҹпјүе…Қиҙ№жЈҖжөӢиҜ•еҚ·
- 2019-2020й«ҳдәҢдёӢеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғйўҳпјҲиҫҪе®ҒзңҒжІҲйҳіеёӮе®һйӘҢдёӯеӯҰпјү
- е®ҒеӨҸеӣһж—ҸиҮӘжІ»еҢәзҹіеҳҙеұұеёӮе№ізҪ—дёӯеӯҰ2020еұҠй«ҳдёүдёҠеҶҢ第дёүж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲ
жңҖиҝ‘жӣҙж–°



