2016-2017年高一上学期期末考试实验小班加试理科综合化学试卷(四川省射洪县)
| 1. | 详细信息 | |||||||||||||||
化学与社会、生活密切相关,下列有关物质的用途和原理分析正确的是
|
||||||||||||||||
| 2. | 详细信息 |
|
用NA表示阿伏加德罗常数,下列叙述不正确的是 A. 高温下,0.3molFe与足量水蒸气反应,转移电子数目为0.8NA B. 3.2g由O2和O3组成的混合物中含有的原子数目为0.2NA C. 在氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.1NA D. 在KClO3+6HCl(浓) ===KCl+3Cl2↑+3H2O反应中,若产生标准状况下6.72LCl2时,转移电子数目为0.6NA |
|
| 3. | 详细信息 |
下列有关装置及其应用的描述中完全正确的是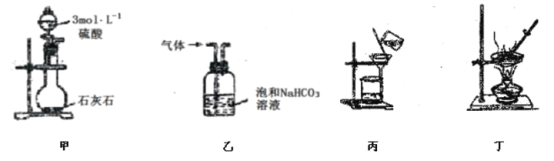 A. 用装置甲制取二氧化碳 B. 用装置乙除去CO2中的HCl C. 用装置丙分离Fe(OH)3胶体与FeCl3溶液 D. 用装置丁制备无水硫酸铜 |
|
| 4. | 详细信息 |
|
已知:还原性强弱:Br? <Fe2+。往100 ml溴化亚铁溶液中缓慢通入2.24 L(标准状况)氯气,反应完成后溶液中有1/2的Br?被氧化成Br2。则原溴化亚铁溶液的物质的量浓度为 A. 1.0mol/L B. 1.5mol/L C. 1.1mol/L D. 1.2mol/L |
|
| 5. | 详细信息 |
|
下列离子方程式中正确的是 A. 漂白粉溶液在空气中失效:ClO-+CO2+H2O ===HClO+HCO3- B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-===Mn2++Cl2↑+2H2O C. 将Fe2O3溶解于足量HI溶液:Fe2O3+6H+ ===2Fe3+ +3H2O D. KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+ ===2H2O+I2 |
|
| 6. | 详细信息 |
|
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100ml,已知溶液中阳离子的浓度相同,且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为 A. 11.2g B. 6.8g C. 19.6g D. 22.4g |
|
| 7. | 详细信息 | |||||||||||||||
下列对应关系正确的是
|
||||||||||||||||
| 8. | 详细信息 |
|
某小组同学采用下列装置在干燥的系统中用Mg粉与氮气直接反应制取Mg3N2 已知:Mg3N2是淡黄色固体,极易与水反应放出氨气,请回答下列问题: 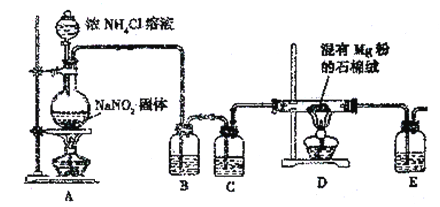 (1)该实验用NaNO2固体与浓NH4CI溶液共热制取N2,请写出该反应的化学方程式 ____。 (2)实验开始时应先点燃A处酒精灯,等到E中产生均气泡后再点燃D处酒精灯,原因是 ___。 (3)B、C、E中有两处装的是浓硫酸,它们是____(填字母),前者的作用是____,后者的作用是____。 (4)若称取7.2gMg粉进行实验,反应完毕后硬质玻璃管质量增加1.8g,请通过简单计算说明Mg粉是否反应完全:____。 |
|
| 9. | 详细信息 |
工业水合碱碳酸镁简称轻质碳酸镁【3MgCO3.Mg(OH)2.3H2O】,相对密度小,质轻而松,广泛用于橡胶制品、防火保湿材料和日货用品中等。一种以富含氯化镁。硫酸镁的卤水和白云石【CaMg(CO3)2】为原料的卤水碳化法生产轻质碳酸镁的工艺流程如下: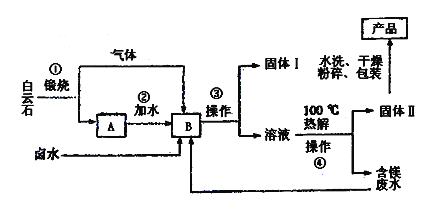 已知:MgCO3比CaCO3更易与CO2反应生成可溶性盐。 (1)为了使第①步白云石煅烧得更充分,常常要对矿石进行__预处理。 (2)第③步和第④步操作的名称是__,在实验室进行该操作时需要的玻璃仪器有 __。 (3)固体I的主要成分为____,固体II的主要成分为____。水洗固体II时,如何判断已经洗净,请简述其过程:____。 (4)写出第④步反应的化学方程式:____。 (5)该流程中能同体现提高效益、减少废物排放思想的两项设计是____。 |
|
| 10. | 详细信息 |
铝土矿是工业生产金属铝的原料,铝土矿的主要成分为氧化铝和水,另外还含有杂质Fe2O3、SiO2等,下图是工业冶炼铝的流程: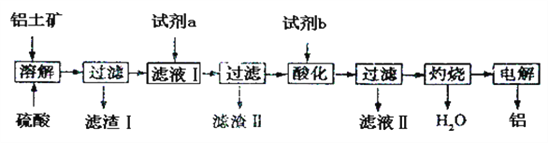 回答下列问题: (1)如流程图所示,第一步为溶解过程,即在铝土矿中加入硫酸,发生反应的离子方程式为____。该过程一般选用硫酸,而不选用盐酸,原因是____。 (2)滤渣I的成分是____(写化学式,下同),滤渣II的成分是____。 (3)实际工业操作中,流程图中的试剂a和试剂b必须过量,试剂a为____,试剂b为____,流程图中,“滤液II”的溶质为____。 (4)一次生产中,铝土矿中氧化铝的含量为48.6%,三次过滤操作中铝的损失率均为6.8%,电解过程中的转化率为92%,其他操作过程没有铝的损失,那么2.00 t 铝土矿可冶炼出金属铝__t。 |
|
| 11. | 详细信息 |
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下: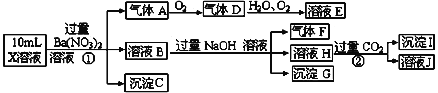 根据以上信息,回答下列问题: (1)配平①中反应的离子方程式: Fe2+ +H+ +NO3- ===Fe3+ +NO↑+H2O ____ (2)上述离子中,溶液X中除H+外还肯定含有的离子是____,不能确定是否含有的离子是__,若要确定其中阳离子的存在,最可靠的化学方法是____。 (3)沉淀G的化学式为____,写出生成沉淀I的离子方程式____。 (4)假设测定A、F、I均为0.01mol,10ml X溶液中n(H+)=0.04mol,当沉淀C物质的量为0.07mol,能说明(2)中不能确定的阴离子存在的理由是____。 |
|
最近更新



