2016-2017年度上学期期末考试九年级化学考题带答案和解析(广州市华龙学校)
| 1. 选择题 | 详细信息 |
|
下列现象前者属于物理变化、后者属于化学变化的一组是 A. 石蜡熔化? 石油分馏 B. 钢铁生锈? 煤气燃烧 C. 干冰降雨? 煤的干馏 D. 白磷自燃? 滴水石穿 |
|
| 2. | 详细信息 |
|
下列各组物质中前者是混合物,后者是化合物 A. 碳酸钙、大理石 B. 水银、硬水 C. 煤气、氧气 D. 食盐水、冰水混合物 |
|
| 3. | 详细信息 |
|
下列关于空气中各组成成分说法正确的是 A. 空气中的N2可作为生产氮肥的原料和食品包装存储的保护气体 B. 空气中的CO2是导致酸雨的主要原因 C. 空气中的O2性质活泼,只有点燃时才能发生化学反应 D. 空气中的稀有气体又叫惰性气体,不与任何物质发生化学反应 |
|
| 4. | 详细信息 |
以下实验基本操作正确的是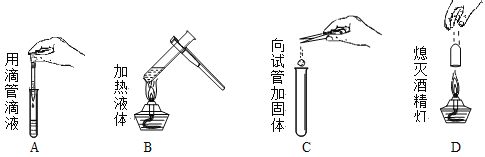 A. A B. B C. C D. D |
|
| 5. | 详细信息 |
|
实验室制取和收集O2,下列操作正确的是 A. 将KClO3和MnO2混合,用纸槽装入试管中,塞上棉花,试管口应倾斜向下加热 B. 将导管口伸入盛满水的集气瓶里,然后加热,立即收集O2 C. 待集气瓶充满O2,在水面上盖好玻璃片后,再移出水槽,正立在桌面上 D. 收集完成后,将导管移出水槽,再熄灭酒精灯 |
|
| 6. | 详细信息 |
|
用“分子的观点”解释下列现象,正确的是 A. 将1体积黄豆与1体积绿豆混合得不到2体积的混合豆,说明分子间一定有间隔 B. 蔗糖放入水中,固体逐渐“消失”,说明蔗糖分子在水的作用下变成原子 C. 铁丝在氧气中燃烧和铁丝在空气中生锈的现象不同,说明两者的氧分子性质不同 D. 水在通电条件下生成氢气和氧气,说明分子在化学变化中发生了变化 |
|
| 7. | 详细信息 |
|
下列关于水的说法不正确的是 A. 用肥皂水可以鉴别软水和硬水,用煮沸或者蒸馏的方法将硬水软化 B. 陆地淡水只约占全球水储量的2.53%,因此我们要节约用水并防止水体污染 C. 乙醇和水的混合物可以用过滤的方法经行分离 D. 电解水时负极产生的气体可以被称为未来的清洁能源 |
|
| 8. | 详细信息 |
|
“给健康加一道菜” 苹果醋中主要成分之一是苹果酸(C4H6O5),下列关于苹果酸的说法错误的是 A. 苹果酸的相对原子质量是134g B. 一个苹果酸分子含有70个质子 C. 一个苹果酸分子含15个原子核 D. 苹果酸中C、H、O元素质量比为24:3:40 |
|
| 9. 选择题 | 详细信息 |
“纸火锅”(如图)是用纸张代替金属材料做容器盛放汤料,当酒精燃烧时纸张不会燃烧。对此现象,下列解释合理的是 A. 纸张不是可燃物,不能燃烧 B. 纸张被水浸湿,导致着火点降低 C. 水蒸发时吸热,温度达不到纸张的着火点 D. 空气不充足,纸张不会燃烧 |
|
| 10. | 详细信息 |
|
下列物质主要成分的化学式错误的是 A. 赤铁矿 Fe2O3 B. 铝土矿 AlO C. 菱铁矿FeCO3 D. 生石灰 CaO |
|
| 11. | 详细信息 |
|
下列化学方程式书写正确的是 A. 2KMnO4 = K2MnO4 + MnO2 + O2↑ B. Fe+ Zn(NO3)2 = Fe(NO3)2+Zn C. 2CO2+Ca(OH)2= Ca(HCO3)2 D. Na2CO3 + H2SO4= Na2SO4+ H2O + CO2 |
|
| 12. | 详细信息 |
|
下列关于化学反应2X +Y ==2Z的叙述,错误的是 A. Z一定是化合物 B. 在反应中X 、Y 、Z三种物质的粒子数目比为2:1:2 C. 若ag X完全反应生成bgZ,则同时消耗(b?a)gY D. 若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为(M+N) |
|
| 13. | 详细信息 |
|
下列说法中,正确的是 A. 石墨具有导电性,可以做电极 B. C、CO和CO2都具有还原性 C. 金刚石、石墨、C60都是由碳原子构成的,其物理性质和化学性质都相同 D. 碳具有可燃性,常温下其化学性质比较活泼 |
|
| 14. | 详细信息 |
|
下列关于二氧化碳和一氧化碳的认识不正确的是 A. 二氧化碳通入紫色石蕊试液中,溶液变成红色,加热该混合液后变成无色 B. 用氢氧化钠溶液除去二氧化碳中少量的一氧化碳杂质气体 C. 除去一氧化碳中少量的二氧化碳气体,可以通过灼热的氧化铜 D. 少量二氧化碳通入澄清石灰水中,澄清石灰水变浑浊 |
|
| 15. | 详细信息 |
|
下列关于合金的说法错误的是 A. 黄铜片能在铜片上刻画出痕迹,说明黄铜的硬度比铜片大 B. 生铁的含碳量是2%-4.3%,钢的含碳量是0.3%-2% C. 钛合金的抗腐蚀性远优于不锈钢,被广泛应用于火箭、导弹、航天飞机等行业 D. 金属材料包括纯金属及其合金,一般合金的熔点比它的组成成分熔点低 |
|
| 16. | 详细信息 |
等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是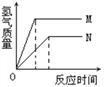 A. M、N两种金属中较活泼的是N B. 生成H2的质量M<N C. 相对原子质量较大的是N D. 产生H2的速率N>M |
|
| 17. | 详细信息 |
|
往12g铝和铁的混合物中加入足量的稀硫酸,充分反应后,产生1g氢气,则混合物中铝的质量分数为 A. 62.3% B. 63.2% C. 36.8% D. 37.7% |
|
| 18. | 详细信息 |
|
在托盘天平两边各放一只烧杯并注入相同的足量稀盐酸,调节至平衡,然后向左、右两边烧杯中分别投入等质量的镁和铝,则天平指针的偏转情况是 A. 先偏向右,最后平衡 B. 先偏向右,最后偏向左 C. 先偏向左,最后偏向右 D. 先偏向左,最后平衡 |
|
| 19. | 详细信息 | ||||||||||||||||||
将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X。测得反应前后的质量如下表:
|
|||||||||||||||||||
| 20. 选择题 | 详细信息 |
|
甲、乙、丙、丁四种金属。甲即使在高温时也不与氧气反应,乙、丙、丁在一定条件下都能与氧气反应。丁盐的水溶液可用丙制的容器盛放,但不能用乙制的容器盛放。这四种金属的活动性由强到弱的顺序是 A. 甲>乙>丁>丙 B. 丙>丁>乙>甲 C. 丙>乙>丁>甲 D. 乙>丁>丙>甲 |
|
| 21. 填空题 | 详细信息 |
|
用化学用语回答下列各题 (1)2个碘分子____________;5个磷原子____________;硫酸铁___________。 (2)二氧化氮中氮元素的化合价为+4价___________________。 (3)磷酸钙中的阳离子____________;硫化亚铁中的阴离子_______________。 |
|
| 22. 简答题 | 详细信息 |
|
按要求写出下列反应的化学方程式 (1)实验室急需一定量的银粉末,科代表小聪认为可用现有的铁金属粉末和银的盐溶液、蒸馏水等药品,配以必要的仪器来制得急需的银粉末,原因是(用反应的化学方程式表示) ______________________________________ (2)N5的分子极不稳定,爆炸式的反应生成氮气。该反应的化学方程式为:___________ (3)金属钛因为有神奇的性能越来越引起人们的关注,常温下钛不与非金属及强酸反应。加热时却可以和常见的非金属单质反应。地壳中的含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是: ①使金红石与碳粉混合,在高温条件下反应,再通过氯气,制得TiCl4和一种可燃性气体。该反应的化学方程式为_____________________________ ②在氩气的气流中,高温下用过量的镁跟TiCl4反应制得金属钛。写出此反应的化学方程式_________________________ (4)氢氧化钴[Co(OH)2]可用作涂料的干燥剂。在二氯化钴(钴显+2价)溶液中加入NaOH溶液,有粉红色的氢氧化钴沉淀生成,该反应的化学方程式为__________________。 (5)乙醇属于可再生资源,写出其燃烧的化学方程式______________________。 |
|
| 23. 填空题 | 详细信息 |
|
铁、铜、铝是我们生活中的常见金属。 (1)上述三种金属中,_____________是地壳中含量最多的金属。 (2)铁用于制铁锅,是利用了其具有良好的_______________性。 (3)用磁铁矿和一氧化碳炼铁的化学方程式为_________________________________。 (4)工业上常用铝土矿来炼铝,化学方程式为2Al2O3====4Al+3O2↑(反应条件省略)。用51t含氧化铝80%的铝土矿,理论上可以炼出金属铝_________________________t。 (5)铜器在潮湿的空气中也容易生锈,铜锈(俗称铜绿)的主要成分是Cu2(OH)2CO3,结合其组成分析,铜生锈是铜与水、氧气和____________共同作用的结果;铜生成铜锈的化学方程式为___________________________________。 |
|
| 24. 填空题 | 详细信息 |
如图,A、B、C、D、E、F均是初中化学的常见物质,A、B、C均含有同一种元素。变化①的现象是颜色由黑变红,变化②的现象是颜色由红变黑,相应变化的生成物没有全部列出,各变化的条件也未标出。回答下列问题: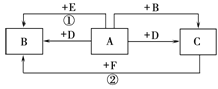 (1)D的化学式为 ; (2)在变化①和②中,A和C的性质是相似的,都具有 ; (3)写出变化①的化学方程式 。 |
|
| 25. 推断题 | 详细信息 |
A是常见金属单质,B、C是非金属单质,且C是密度最小的气体,甲是磁铁矿的主要成分,乙是无色液体,它们之间有如下的转化关系(部分产物和反应条件未标明)。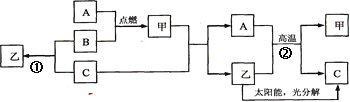 (1)推断C的化学式为:C ______________; (2)A在B中点燃的实验现象是___________________________; (3)写出反应①的化学方程式___________________________; (4)写出反应②的化学方程式_________________________。 |
|
| 26. 实验探究题 | 详细信息 |
下图是实验室中用于制取和收集气体的装置图。 请回答: (1)仪器①的名称是:___________________。 (2)以上装置图中有一处明显的错误,请写出改正后的结果_________________。 (3)用高锰酸钾制取氧气,应选用的发生装置是__________(填字母编号,下同),装入药品前必须进行的一步操作是_____________________,用氯酸钾和二氧化锰混合物加热反应制取氧气的化学方程式为______________________;用B装置制取氧气时候,应注意___________________________,以防氧气逸出;当用装置C收集满O2,并取出集气瓶后,停止该实验的正确操作是___________________________。 (4)实验室制取二氧化碳,应选用的收集装置是________________,反应的化学方程式是 _______________________;用澄清石灰水检验二氧化碳时,发生反应的化学方程式为_________________。 |
|
| 27. 简答题 | 详细信息 |
下图所示装置可以验证某混合气体(无色无味)是否含有CO2和CO。?  请回答下列问题: (1)B装置中的试剂是(写名称,下同)_______________; (2)证明原混合气体中CO存在的实验现象是_____________________________; |
|
| 28. 简答题 | 详细信息 |
|
2009年3月7日起福州市民陆续使用天然气。福州市区家用燃料的更新历程如下: (1)下列有关家用燃料更新的理由,不正确的是_________________。 A.天然气是可再生的能源 B.气体燃料的利用率更高 C.减少煤燃烧过程中产生的污染物 (2)某居民家中每年冬季取暖用煤约400Kg,所用煤中含硫的质量分数约1%。若其中的硫元素全部转化为二氧化硫,那么该居民家中每年冬季取暖向大气中排放约_________ Kg的二氧化硫。 (3)天然气(主要成分是甲烷)和液化石油气(主要成分是丙烷和丁烷)中碳元素的质量分数分别约为75%和82.3%,通过该数据分析:相同条件下,用天然气作燃料比液化石油气更环保的理由是____________________________________。 (4)甲烷在空气中完全燃烧的化学方程式为_____________________________________。 |
|
| 29. 计算题 | 详细信息 | ||||||||||||
我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15mL稀盐酸分三次加入到5g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
|
|||||||||||||
最近更新



