高中化学人教版 选修三 第2章 分子结构与性质 键参数--键能、键长与键角
| 1. 选择题 | 详细信息 |
|
根据π键的成键特征判断C==C双键键能是C?C单键键能的 (? ) A.2倍 B.大于2倍 C.小于2倍 D.无法确定 |
|
| 2. 选择题 | 详细信息 |
|
下列单质分子中,键长最长,键能最小的是 (? ) A.H2 B.Cl2 C.Br2 D.I2 |
|
| 3. 选择题 | 详细信息 |
|
下列说法中正确的是 (? ) A.难失去电子的原子,获得电子的能力一定强 B.易得到电子的原子所形成的简单阴离子,其还原性一定强 C.分子中键能越大,键长越长,则分子越稳定 D.电子层结构相同的简单离子,核电荷数越多,离子半径越小 |
|
| 4. 选择题 | 详细信息 |
|
下列事实不能用键能的大小来解释的是 (? ) A.N元素的电负性较大,但N2的化学性质很稳定 B.稀有气体一般难发生反应 C.HF、HCl、HBr、HI的稳定性逐渐减弱 D.F2比O2更容易与H2反应 |
|
| 5. 选择题 | 详细信息 | ||||||||||
已知通常分子中所含的键能越大,分子越稳定。参考下表中化学键的键能数据,判断下列分子中,受热时最不稳定的是 (? )
A.氢气 B.氯化氢 |
|||||||||||
| 6. 选择题 | 详细信息 |
|
在白磷(P4)分子中,4个P原子分别处在正四面体的四个顶点,结合有关P原子的成键特点,下列有关白磷的说法正确的是 (? ) A.白磷分子的键角为109°28′ B.分子中共有4对共用电子对 C.白磷分子的键角为60° D.分子中有6对孤电子对 |
|
| 7. 选择题 | 详细信息 |
|
H2和I2在一定条件下能发生反应:H2(g)+I2(g) 已知: 下列说法正确的是 (? ) A.H2、I2和HI分子中的化学键都是非极性共价键 B.断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJ C.相同条件下,1 mol H2(g)和1 mol I2(g)总能量小于2 mol HI(g)的总能量 D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ |
|
| 8. 选择题 | 详细信息 |
|
N2的结构可以表示为 A.N2分子与CO分子中都含有三键 B.CO分子与N2分子中的π键并不完全相同 C.N2与CO互为等电子体 D.N2与CO的化学性质相同 |
|
| 9. 选择题 | 详细信息 |
下表为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 (? )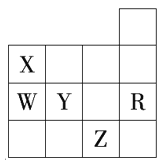 A.W、R元素单质分子内都存在非极性键 B.X、Z元素都能形成双原子分子 C.键长W?H<Y?H,键的极性Y?H>W?H D.键长X?H<W?H,键能X?H<W?H |
|
| 10. 选择题 | 详细信息 |
|
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ?mol-1, P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ?mol-1, 又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ?mol-1,PCl3中P-Cl键的键能为1.2c kJ?mol-1。下列叙述正确的是 A. P-P键的键能大于P-Cl键的键能 B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH C. Cl-Cl键的键能为(b-a+5.6c)/4 kJ?mol-1 D. P-P键的键能为(5a-3b+12c)/8 kJ?mol-1 |
|
| 11. 填空题 | 详细信息 | ||||||||||||||||
下表为某些化学键的键能(单位:kJ?mol-1)。
(1)下列氢化物中,最稳定的是__________。 |
|||||||||||||||||
| 12. 填空题 | 详细信息 | ||||||||||||
根据氢气分子的形成过程示意图(如下图)回答问题: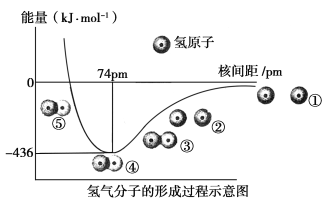 (1)H?H键的键长为________,①~⑤中,体系能量由高到低的顺序是________。 (2)下列说法中正确的是( ) A.氢气分子中含有一个π键 B.由①到④,电子在核间出现的几率增大 C.由④到⑤,必须消耗外界的能量 D.氢气分子中含有一个极性共价键 (3)几种常见化学键的键能如下表:
请回答下列问题: |
|||||||||||||
| 13. 填空题 | 详细信息 |
|
(1)CH (2)叠氮化合物在化学工业上有重要应用。N (3)N≡N键的键能为946 kJ/mol,N?N键的键能为193 kJ/mol,说明N2中的________键比________键稳定(填“σ”或“π”) (4)CaC2中C |
|
最近更新



