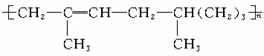2018广东高三上学期人教版高中化学高考真题
| 1. | 详细信息 |
|
人类未来最理想的燃料是 A.煤 B.石油液化气 C.氢气 D.水煤气 |
|
| 2. | 详细信息 |
|
能证明氯化氢是共价化合物的是 A.氯化氢易溶于水 B.液态氯化氢不导电 C.氯化氢在水中完全电离 D.氯化氢比较稳定 |
|
| 3. | 详细信息 |
|
I-在水溶液中能被臭氧(O3)氧化生成单质碘的同时产生O2,这个反应的氧化产物和还原产物分别是 A.I2和OH- B.I2和O2 C.OH-和I2 D.都是I2 |
|
| 4. | 详细信息 |
|
在五瓶有编号的试管里分别装有K2CO3,KNO3,K2SO4,KOH和Ba(OH)2溶液,现需用最少种类的试剂将它们一一区别开来,则所需试剂的种类是 A.不用任何其他试剂 B.用一种试剂 C.用两种试剂 D.用三种试剂 |
|
| 5. | 详细信息 |
|
把足量的CO2通过0.2 mol Na218O2,当完全反应后,碳酸钠的质量是 A.21.2 g B.22.4 g C.在21.2 g~22.4 g之间 D.无法计算 |
|
| 6. | 详细信息 |
|
某溶液滴入甲基橙显红色,在这种溶液中能大量共存的离子是 A.Mg2+、K+、Br-、SO B.S2O C.Ca2+、K+、ClO-、I- D.Al3+、K+、AlO |
|
| 7. | 详细信息 |
|
甲烷是一种高效清洁的新能源,0.25 mol甲烷完全燃烧生成液态水时放出222.5 kJ热量,则下列方程式中正确的是 A.2CH4(g)+4O2(g)===2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1 B. CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1 C.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 D. CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890 kJ·mol-1 |
|
| 8. | 详细信息 |
|
实验室保存少量药品:①白磷;②金属钠;③红磷;④液溴;⑤苯。其中需用水封的是 A.只有② B.①③ C.①④ D.③⑤ |
|
| 9. | 详细信息 |
|
有以下四种判断:①两种弱酸相互反应生成两种强酸;②两种弱酸盐相互反应生成两种强酸盐;③两种酸溶液相互反应后溶液的酸性减弱;④一种酸和一种盐溶液反应后溶液的酸性增强。其中有具体例证的是 A.①② B.①③④ C.②③④ D.①②③④ |
|
| 10. | 详细信息 |
|
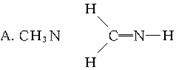
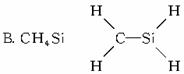
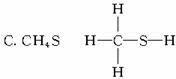
下列化学式的结构中,从成键情况看不合理的是
|
|
| 11. | 详细信息 |
|
区别CH3CH2CH2OH和CH3CH(OH)CH3的方法是 A.加金属钠 B.加银氨溶液、水浴加热 C.在铜存在下和氧气反应 D.在银存在下和氧气反应后,再在产物中加银氨溶液水浴加热 |
|
| 12. | 详细信息 |
|
有科学家提出硅是“21世纪的能源”“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,利用其有利因素的下列说法中,你认为不妥的是 A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 B.自然界中存在大量的单质硅 C.硅燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制 D.自然界硅的化合物易开采,且可再生 |
|
| 13. | 详细信息 |
|
.已知HIO既能与酸又能与碱发生中和反应,则它与盐酸反应的产物有 A.IO- B.I2O C.I- D.ICl |
|
| 14. | 详细信息 |
|
某溶液中含有HCO A.CH3COO- B.SO |
|
| 15. | 详细信息 |
|
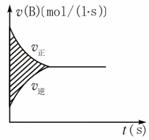
如图表示容积固定的2 L密闭容器中进行的某一可逆反应:A(g)+2B(g)
A.A浓度的减少 B.B浓度的减少 C.C物质的量增加 D.B物质的量减少 |
|
| 16. | 详细信息 | ||||||||
|
下图表示尾气吸收或处理装置, 现需处理的气体是:①C12 ②NH3 ③HCl ④H2S ⑤CO,请从中选取一种最合适的装置,将要处理的气体编号填入相应的装置图的下方空格中。
|
|||||||||
| 17. | 详细信息 |
|
在下列物质间的转化关系中,A是一种正盐,Z通常为液态,D的相对分子质量比C的相对分子质量大16,当X无论是强酸还是强碱时,其转化关系如图所示: A (1)当X是强酸时,A,B,C,D,E均含有同一元素,请回答(填化学式): A是 ,Y是 ,Z是 。 (2)当X是强酸时,E是 ;当X是强碱时,E是 。 |
|
| 18. | 详细信息 |
|
次磷酸(H3PO2)是一种强还原性弱酸,它能发生如下图所示的反应:
(1)CuX中X表示一种元素,这种元素是 。 (2)CuX是离子化合物,其电子式为 。 (3)反应(Ш)的离子方程式为: 。 (4)反应(Ⅱ)中,当有1 mol CuX被氧化时,转移的电子数目为 个。 |
|
| 19. | 详细信息 |
|
高聚物分子的单体的结构简式分别是: 。 |
|
| 20. | 详细信息 |
|
碳、氢、氧、氮是构成生命物质最主要的四种元素,请根据所给的条件,回答下列问题: (1)写出由上述四种元素组成的可用作炸药的两种物质的结构简式 ① ,② 。 (2)写出符合下列要求的物质的结构简式或分子式。 ①由上述四种元素中的三种组成的天然高分子的结构简式(任写一种) 。 ②A、B两种共价化合物,它们均含上述四种元素,且互为同分异构体;它们的一分子中都含有两个碳原子,A可发生缩聚反应,B分子中含40个电子,且通常为中性,则A、B结构简式分别为:A ;B 。 |
|
| 21. | 详细信息 |
|
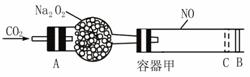
)已知2NO2
(1)已知当活塞移至C处时,干燥管中物质增加了2.24 g,此时通入的CO2气体在标准状况下为多少L?容器甲中NO2转化为N2O4的转化率为多少? (2)当活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至B处,则a值必小于0.01,其理由是 。 |
|
| 22. | 详细信息 |
|
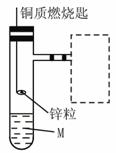
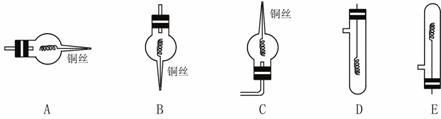
如下图是实验室用氢气还原氧化铜实验的简易装置。其中的铜质燃烧匙可以在试管M中上下移动,虚线框中需连入图乙(仪器的上下端位置固定)的某装置进行实验。图乙中的细铜丝一端被弯成螺旋状,先将铜丝在空气中加热变黑后再迅速伸入制得的氢气中。
(1)在下图中,试管M中的液体应选用 。 (2)在下图中的虚线框中应连入的最合适的装置是图乙所示仪器中的 。
图乙实验仪器 (3)上述制氢气的方法与将锌直接加入试管中相比,其优点有 。 (4)实验过程中,在试管M中可观察到的现象是 。 (5)用上面的装置也可以做氨气还原氧化铜的实验,其产物对空气无污染,对应的化学反应方程式为 。在这个实验中,试管M中的液体应选用 ,小匙上的固体应该选用 。 |
|
| 23. | 详细信息 |
|
已知有关物质及离子的氧化性强弱顺序为:浓硫酸>Fe3+>H+。现将30 g铁粉(过量)与44.0 mL浓硫酸在加热条件下充分反应,共收集到11.2 L(标准状况下)气体,其质量为19.6 g。试计算: (1)浓硫酸的物质的量浓度; (2)反应后剩余铁粉的质量。 |
|