2019天津高一上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
可用于治疗胃酸过多的物质是 A. 碳酸氢钠 B. 氯化钠 C. 氯化钾 D. 氢氧化钠
|
|
| 2. | 详细信息 |
|
用铝合金代替铝制钥匙,因为铝合金 A. 熔点低 B. 不易锈蚀 C. 硬度大 D. 密度小
|
|
| 3. | 详细信息 |
|
潮湿氯气、新制氯水以及次氯酸钠溶液都能使有色布条褪色,因为它们都含有微粒 A. HClO B. ClO- C. HCl D. Cl2
|
|
| 4. | 详细信息 |
|
光纤通信是一种现代化的通信手段,制造光导纤维的主要原料是 A. Na2SiO3 B. Ag C. CaCO3 D. SiO2
|
|
| 5. | 详细信息 |
|
下列各组中的两种物质相互反应,无论哪种过量,都可用同一个离子方程式表示的是 ①碳酸钠溶液与稀盐酸 ②氯化铝溶液与氢氧化钠 ③二氧化硫与氨水 ④漂白粉溶液和二氧化碳 ⑤铝与氢氧化钠溶液 ⑥碳酸氢钠溶液与澄清石灰水 A. 仅有⑤ B. ①③⑥ C. ③⑤ D. ②④
|
|
| 6. | 详细信息 |
|
将一粒钠投入下列溶液中,能产生气体和沉淀的是 A. NaCl B. BaCl2 C. H2SO4 D. CuCl2
|
|
| 7. | 详细信息 |
|
某溶液中加入铝粉能产生氢气,在该溶液中一定不能大量共存的离子组是 A. Na+、K+、Cl-、ClO- B. Cu2+、Fe2+ 、HCO3-、SO42- C. Na+、K+、Cl-、SO42- D. K+、 NH4+、 Cl-、SO42-
|
|
| 8. | 详细信息 |
|
下列离子方程式错误的是 A. 盐酸与烧碱溶液反应:H++OH-===H2O B. 澄清石灰水中通入CO2变浑浊:CO2+Ca2++2OH-===CaCO3↓+H2O C. 向氯化铝溶液中加入足量氨水:Al3++3OH-===Al(OH)3↓ D. Cl2与水反应生成盐酸和次氯酸:Cl2+H2O
|
|
| 9. | 详细信息 |
|
下列说法中正确的是 ①钠在空气中燃烧生成白色的氧化钠 ②钠投入硫酸铜溶液中有红色粉末产生 ③过氧化钠可在防毒面具中做供氧剂 ④铁丝在氯气中燃烧产生的红棕色烟为FeCl3 ⑤钠、氢气在氯气中燃烧都能产生白烟 A. ①② B. ②③ C. ③④ D. ④⑤
|
|
| 10. | 详细信息 |
|
下列各组物质能相互反应得到Al(OH)3的是 A. Al与NaOH溶液共热 B. AlCl3与过量的NaOH溶液 C. Al2O3与水共热 D. Al2(SO4)3与过量氨水
|
|
| 11. | 详细信息 |
|
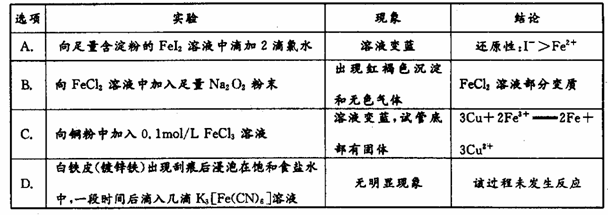
下列实验对应的现象及结论均正确且两者具有因果关系的是
A. A B. B C. C D. D
|
|
| 12. | 详细信息 |
|
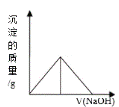
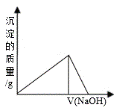
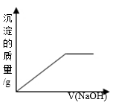
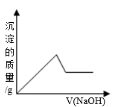
向Fe2 (SO4)3 和Al2 (SO4)3 的混合溶液中,逐滴加入NaOH溶液至过量。下列图象中,能正确表示上述反应的是( ) A.
|
|
| 13. | 详细信息 |
|
称取两份等质量的铝粉,分别加入等体积等物质量浓度的浓NaOH溶液与盐酸溶液。若最终铝全部溶解,则放出H2的体积比(同温同压下)是 A. 1:1 B. 1:2 C. 1:3 D. 3:1
|
|
| 14. | 详细信息 |
|
向100 mL 0.250 mol/L的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是 A. 2.30 g B. 3.45g C. 1.15 g D. 0.575 g
|
|
| 15. | 详细信息 |
|
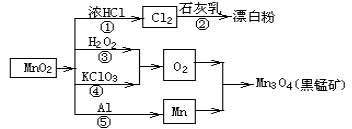
根据如图的转化关系判断下列说法正确的是(反应条件已略去)
A. 反应①②③④⑤均属于氧化反应和离子反应 B. 反应⑤说明该条件下铝的还原性强于锰 C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 D. 反应①中氧化剂与还原剂的物质的量之比为1:4
|
|
| 16. | 详细信息 |
|
证明某溶液含有Fe2+而不含有Fe3+的实验方法是 ①先加氯水,后加KSCN溶液后显红色 ②先加KSCN溶液,不显红色,再加氯水后显红色 ③滴加NaOH溶液,先产生白色沉淀,迅速变为灰绿色,最后呈红褐色 ④只滴加KSCN溶液不显红色 A. ①② B. ②③ C. ③④ D. ①④
|
|
| 17. | 详细信息 |
|
过氧化钠跟足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却残留的固体物质是 A. Na2O2、Na2CO3 B. NaOH、Na2CO3 C. Na2CO3 D. Na2O2、NaOH、Na2CO3
|
|
| 18. | 详细信息 |
|
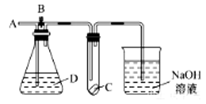
如图所示,A处通入干燥的Cl2,打开B阀后,C处的湿润红布条逐渐褪色;关闭B阀时,C处的湿润红布条无明显现象。则D瓶中装的是
A. 浓硫酸 B. NaOH溶液 C. 浓盐酸 D. 饱和NaCl溶液
|
|
| 19. | 详细信息 |
|
新制氯水的成分复杂,但饱和氯水久置后,成分发生变化,下列粒子①Cl2;②H2O;③Cl-;④HClO;⑤ H+,因饱和氯水久置而减少的是 A. ①②③ B. ①④ C. ②④ D. ①②④
|
|
| 20. | 详细信息 |
|
下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是 A. FeCl2 B. AlCl3 C. FeCl3 D. CuCl2
|
|
| 21. | 详细信息 |
|
2012年10月29日,超强飓风“桑迪”登陆美国东海岸,给人们的生命财产造成巨大损失。灾区人们的饮水必须用漂白粉等药品消毒后才能饮用,以防止传染病发生。 (1)试用化学方程式表示工业制取漂白粉的过程______________________________; (2)若用KMnO4氧化盐酸。其反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是____,1 mol氧化剂在反应中_______(填“得到”或“失去”)______mol电子。当有1mol KMnO4恰好和盐酸全部完全反应,反应后溶液的体积为2L,则所得溶液中Cl—的物质的量浓度为_______,此时产生的Cl 2在标准状况下的体积为_______,被氧化的HCl的物质的量为________。
|
|
| 22. | 详细信息 |
|
钠、铝、铁是三种重要的金属。请回答: (1)钠元素的金属性比铝的________(填“强”或“弱”)。 (2)将一小块金属钠投入水中,发生反应的离子方程式为______________;可观察到的实验现象是________(填序号)。 a.钠沉到水底 b.钠熔成小球 c.小球四处游动 (3)呼吸面具的原理:________________,_______________________。 (4)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。将该产物溶于水配成溶液,分装在两支试管中。请回答: a.若向其中一支试管中滴加KSCN溶液,则溶液变成________色。 b.向另一支试管中滴加NaOH溶液,现象为___________________________,反应的离子方程式是________________________________________________。
|
|
| 23. | 详细信息 |
|
将铁粉投入到盛有Cu2+、Ag+、Fe3+的溶液中,反应完毕时,若烧杯底部有铁粉剩余,溶液中一定不含的金属离子是_______,若烧杯中没有铁粉剩余,则溶液中一定含有的金属离子是_______,若溶液中不含有Cu2+时,则一定不含有的金属离子是_______。
|
|
| 24. | 详细信息 |
|
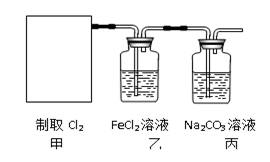
氯气是一种重要的工业原料。 (1)写出实验室制取氯气反应的化学方程式________________________。 (2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4
①在该实验中,甲部分的装置是_______(填字母)。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________。 ③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是_______(化学式)。 ④有人认为该实验存在明显的缺陷,如何改进:______________ 请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式______________。
|
|