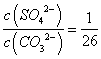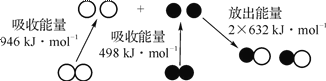2018河北高二下学期人教版高中化学开学考试
| 1. | 详细信息 |
|
下列说法不正确的是( ) A. 能量较高、有可能发生有效碰撞的分子称为活化分子 B. 活化分子的平均能量与所有分子的平均能量之差称为活化能 C. 催化剂能参与反应,可降低原反应所需活化能 D. 非活化分子也有可能发生有效碰撞
|
|
| 2. | 详细信息 |
|
下列说法中正确的是 ( ) A.焓变是指1 mol物质参加反应时的能量变化 B.反应放热时,ΔH>0;反应吸热时,ΔH<0 C.在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同 D.在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓
|
|
| 3. | 详细信息 |
|
已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( ) A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1 C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
|
|
| 4. | 详细信息 |
|
100 mL 0.1 mol·L-1醋酸与50 mL 0.2 mol·L-1NaOH溶液混合,在所得溶液中下列有关离子浓度大小关系式正确的是( ) A. c (Na+)>c (CH3COO-)>c(OH-)>c(H+) B. c(Na+)>c(CH3COO-)>c(H+)>c(OH-) C. c(Na+)>c(CH3COO-)>c(H+)=c(OH-) D. c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
|
|
| 5. | 详细信息 | ||||||||||||||
|
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) A. +412 kJ·mol-1 B. -412 kJ·mol-1 C. +236 kJ·mol-1 D. -236 kJ·mol-1
|
|||||||||||||||
| 6. | 详细信息 |
|
下图是198 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
A.该反应的热化学方程式为:N2 + 3H2 B.向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 C.b曲线可能是加入催化剂时的能量变化曲线 D.加入正催化剂可增大正反应速率,降低逆反应速率
|
|
| 7. | 详细信息 |
|
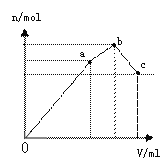
一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)
A. 反应开始2 min内,v(B)=0.1 mol/(L·min) B. t1时改变的条件可能是升高温度 C. t3时改变的条件可能是加压,此时c(B)不变 D. t4时可能是使用了催化剂,此时c(B)不变
|
|
| 8. | 详细信息 |
|
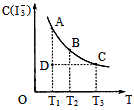
I2在KI溶液中存在下列平衡: I2(aq)+I-(aq)一I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
A. 反应I2(aq)+ I-(aq)= I3-(aq) △H<0 B. 若温度为T1、T2反应的平衡常数分别为K1、K2,则K1 >K2 C. 若反应进行到状态D时,一定有v正 >v逆 D. 状态A 与状态B相比,状态A 的c(I2)大
|
|
| 9. | 详细信息 |
|
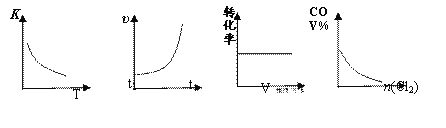
COCl2(g)
① ② ③ ④ A. ①表示随温度升高,平衡常数的变化 B. ②表示加入催化剂,反应速率随时间的变化 C. ③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化 D. ④表示CO的体积分数随充入Cl2量的变化
|
|
| 10. | 详细信息 |
|
25℃时,Ksp(BaSO4)=1×10-10,Ksp (BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( ) A. 同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 B. BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 C. BaSO4和BaCO3共存的悬浊液中, D. BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
|
|
| 11. | 详细信息 |
|
下列说法正确的是( ) A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3 B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性 C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同 D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
|
|
| 12. | 详细信息 |
|
用0.1000mol·L-1NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是( ) A. 盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗 B. 酸式滴定管在使用前未用待测液盐酸润洗 C. 滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失 D. 滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度
|
|
| 13. | 详细信息 |
|
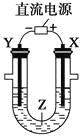
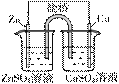
利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是 ( )
A. 氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑ B. 电解精炼铜时,Z溶液中的Cu2+浓度不变 C. 在铁片上镀铜时,Y是纯铜 D. 制取金属镁时,Z是熔融的氯化镁
|
|
| 14. | 详细信息 |
|
下列说法正确的是( ) A. 铅蓄电池放电时铅电极发生还原反应 B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠 C. 给铁钉镀铜可采用CuSO4作电镀液 D. 生铁浸泡在食盐水中发生析氢腐蚀
|
|
| 15. | 详细信息 |
|
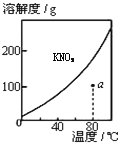
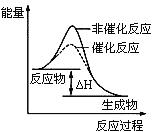
下列图示与对应的叙述不相符的是
图1 图2 图3 图4 A. 图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 B. 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 C. 图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 D. 图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
|
|
| 16. | 详细信息 |
|
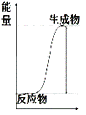
下列反应过程中能量变化符合如图所示的是( )
A. C+CO2 B. Zn+H2SO4=ZnSO4+H2↑ C. CH4+2O2 D. KOH+HNO3=KNO3+H2O
|
|
| 17. | 详细信息 |
|
下列说法中,正确的是( ) A. 催化剂在化学反应前后本身的质量和化学性质都没有改变,所以在反应过程中催化剂没有参与化学反应 B. 将水库中的水闸(钢板)与外加直流电源的正极相连,负极连接到一块废铁上可防止水闸被腐蚀 C. 在化学反应在一定温度下进行的过程中释放或吸收的热量称为该反应在此温度下的反应热,又称为“焓变” D. 己知热化学方程式:S (s) +O2 (g) =SO2(g) △H =a kJ • mol-1,S (g) +O2(g) =SO2 (g) △H =b kJ • mol-1,则 b>a
|
|
| 18. | 详细信息 |
|
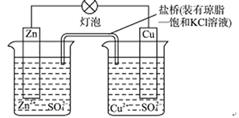
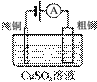
.铜锌原电池(如图)工作时,以下说法正确的是 ( )
①电子流动方向从Zn—灯泡—Cu—盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+=Zn2++Cu;⑤Zn电极失电子发生还原反应 A.①②③ B.②④⑤ C.②③④ D.③④⑤
|
|
| 19. | 详细信息 |
|
.已知H2(g)+I2(g) A. 甲、乙提高相同温度 B. 甲中加入0.1molHe,乙中不变 C. 甲降低温度,乙增大压强 D. 甲增加0.1molH2,乙增加0.1molI2
|
|
| 20. | 详细信息 |
|
已知:4NH3 (g)+5O2 (g)
A. A B. B C. C D. D
|
|
| 21. | 详细信息 |
|
下列有关热化学方程式及其叙述正确的是( ) A. 氢气的燃烧热为285.5 kJ/mol,则水电解的热化学方程式为: 2H2O(l) =2H2(g)+O2(g) △H=+285.5 kJ/mol B. lmol甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为:
C. 己知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1,则C(S)的燃烧热为-110. 5kJ/mol D. HF与NaOH 溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol
|
|
| 22. | 详细信息 |
|
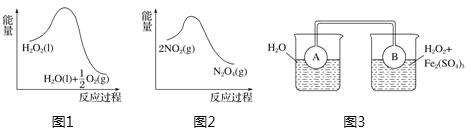
利用图1 和图2中的信息,按图3装置(连接的A、B瓶中已充有NO2气体)进行实验。下列说法正确的是( )
A. H2O2中只含有极性共价键,不含离子键 B. 2NO2 C. 向H2O2中加入Fe2(SO4)3后,B中颜色变浅 D. H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小
|
|
| 23. | 详细信息 |
|
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
A. 放电条件下,N2(g)和O2(g)混合能直接化合生成NO(g) B. NO是一种酸性氧化物,能用NaOH溶液处理含NO的尾气 C. N2(g)和O2(g)反应生成 NO(g),相当于N2(g)在O2(g)燃烧,该反应放热 D. 28 g N2(g)和32 g O2(g)完全反应生成 NO(g),放出的能量为180 kJ
|
|
| 24. | 详细信息 |
|
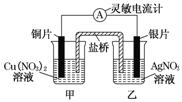
用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池流向甲池 B.铜导线替换盐桥,原电池仍继续工作 C.开始时,银片上发生的反应是:Ag-e-=Ag+ D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
|
|
| 25. | 详细信息 | ||||||||||||
|
下列表述不正确的是( )
|
|||||||||||||
| 26. | 详细信息 | ||||||||||||||||
|
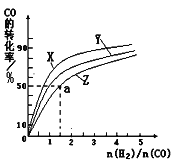
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为: CO(g)+ 2H2(g) (1)已知:
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式:________________ (2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
①在上述三种温度中,曲线Z对应的温度是________________ ②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g) (3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度 (mol•L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是_________________________。
|
|||||||||||||||||
| 27. | 详细信息 |
|
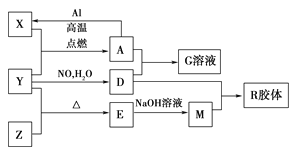
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁,E是不溶于水的酸性氧化物,能与氢氟酸反应。
回答下列问题: (1)组成单质Z的元素在周期表中的位置是________;M中存在的化学键类型为________;R的化学式是______________。 (2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为____________。 (3)已知A与1 mol Al反应转化为X时(所有物质均为固体),放出a kJ热量。写出该反应的热化学方程式:_____________________________________________________________。 (4)写出A和D的稀溶液反应生成G的离子方程式:__________________________________。
|
|
| 28. | 详细信息 | |||||||||||||||||||||||||||||||||
|
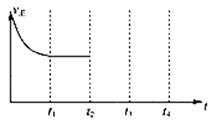
2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。 (1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ①能判断该反应达到平衡状态的标志是____________________。 A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变 C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化 ②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ. ①该反应的热化学方程式为______________________________________________ ②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: (3)已知反应:CO(g)+H2O(g)
①实验1条件下平衡常数K=______________(保留小数点后二位)。 ②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。 ③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。
|
||||||||||||||||||||||||||||||||||
| 29. | 详细信息 |
|
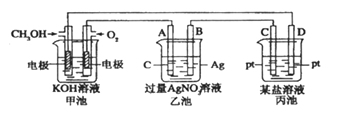
下图是一个电化学过程的示意图,请回答下列问题:
(1)图中甲池是_________ (填“原电池” “电解池”或“电镀池”)。 (2)A(石墨)电极的名称是_________ (填“正极” “负极” “阴极”或“阳极”) (3)写出通入CH3OH的电极的电极反应式________________ (4)乙池中反应的化学方程式为__________________。当乙池中B(Ag)极质量增加54g,甲池中理论上消耗O2的体积为____L(标准状况)。
|
|