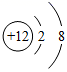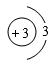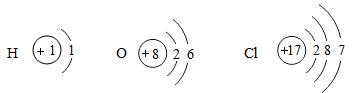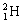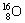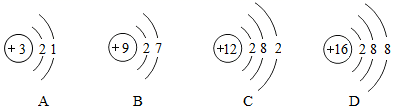初中化学九年级上2020-2021学年度——原子的结构综合复习题(二)含详解
| 1. | 详细信息 |
|
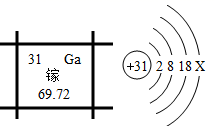
我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原子质量新值,其中他测定核电荷数为 63 的铕元素的相对原子质量的新值为 152 。下列说法正确的是( ) A . 铕元素的原子中子数为 63 B . 铕元素的原子质子数为 63 C . 铕元素的原子核外电子数为 152 D . 铕元素的原子的质量为 152g |
|
| 2. | 详细信息 |
|
美英联军在伊拉克战场上,不顾全世界人民的反对,使用了后患无穷的贫油弹,其中含有 U-238 ,它的相对原子质量为 238 ,质子数为 92 ,则 U-238 中含有的电子数为( ) A . 238 B . 92 C . 146 D . 330 |
|
| 3. | 详细信息 |
|
居里夫人在 1898 年从几吨含铀废料中提炼出 0.3g 镭。镭元素的核电荷数为 88 ,相对原子质量为 226 ,镭原子的质子数为 A . 226 B . 88 C . 138 D . 314 |
|
| 4. | 详细信息 |
|
下列关于分子和原子的说法错误的是 ( ) A . “ 墙内开花墙外香 ” 说明分子在不停运动 B . 在化学变化中,分子可以再分,原子不可分 C . “ 热胀冷缩 ” 说明分子的体积随温度的变化而变化 D . 在原子中,质子数一定等于核外电子数,但不一定等于中子数 |
|
| 5. | 详细信息 |
|
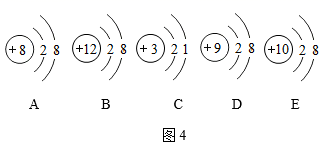
对分子、原子、离子的认识不正确的是( ) A . 分子、原子、离子都是构成物质的微粒 B . 原子是化学变化中的最小粒子 C . 化学变化中,分子、原子、离子种类都没变,因此,化学反应中质量守恒 D . 温度越高,分子运动速率越快 |
|
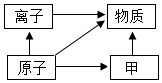
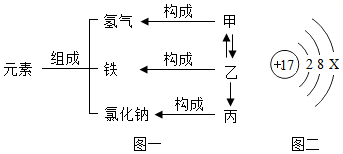
| 6. | 详细信息 |
|
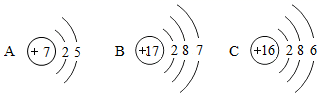
下列有关元素、原子、离子、分子的说法中,正确的是( ) A . Na 与 Na + 是同种元素 B . 分子是化学变化中的最小微粒 C . 原子的质量主要集中在电子上 D . 原子得到电子后形成阳离子 |
|
| 7. | 详细信息 |
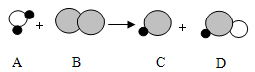
|
Fe 、 Fe 2+ 、 Fe 3+ 三种粒子中肯定不同的是( ) A . 核电荷数 B . 质子数 C . 中子数 D . 电子数 |
|
| 8. | 详细信息 |
|
下列有关原子、分子和元素的说法不正确的是 A .元素的化学性质主要决定于其原子的最外层电子数 B .分子可以分成原子,而原子不能再分,原子是最小的粒子 C .由分子构成的物质,分子是保持其化学性质的最小粒子 D .敞口放置的酒精慢慢地少了,是酒精分子不断运动的结果 |
|
| 9. | 详细信息 |
|
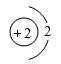
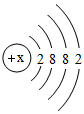
小华同学依据描述书写的化学符号: ①两个氮气分子: 2N 2 ; ②由三个氧原子构成的臭氧分子: 3O ; ③粒子结构示意图: ④两个铁离子: 2Fe 3+ ; ⑤地壳中含量最多的元素是: O ; ⑥ +2 价的镁元素: Mg 2+ 。 其中,正确的是 ( ) A . ①③④ B . ②④⑤ C . ①④⑤ D . ①④⑥ |
|
| 10. | 详细信息 |
|
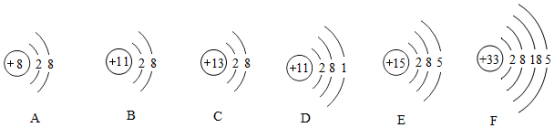
金属钛的熔点高、密度小、抗腐蚀性能好,用途极广泛。已知钛原子的质子数为 22 ,中子数为 26 ,则该元素原子的电子数和相对原子质量为 ( ) A . 48 , 26 B . 26 , 48 C . 22 , 48 D . 48 , 48 |
|
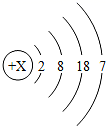
| 11. | 详细信息 |
|
元素 X 的核电荷数为 a ,它们的阳离子 X m+ 与元素 Y 的阴离子 Y n- 的电子层结构相同,则元素 Y 核电荷数为 A . m+n+a B . m-n-a C . a-m-n D . m+n-a |
|
| 12. | 详细信息 |
|
下列说法 不正确 的是( ) A . 所有原子都是由质子、中子和电子构成 B . 质子数相同的微粒不一定属于同一种元素 C . 在原子中,质子数与电子数一定相等 D . 在原子中,质子数与中子数不一定相等 |
|
| 13. | 详细信息 |
|
2020 年 12 月 17 日 1 时 59 分,嫦娥五号返回器携带月壤在内蒙古四子王旗预定区域成功着陆,标志着我国首次地外天体采样返回任务圆满完成。 “嫦娥”的任务之一是探测月球上氦 -3 (质子数为 2 ,中子数为 1 的原子)资源。下列关于氦 -3 原子的原子结构示意图中正确的是 A . |
|
| 14. | 详细信息 |
|
下列物质的构成微粒与 C 60 的构成微粒类型相同的是 A . 金刚石 B . 氯化钠 C . 氧气 D . 铁 |
|
| 15. | 详细信息 |
|
下列各组物质中都是由分子构成的是( ) A . C 60 、 NH 3 B . Fe 、 He C . NaCl 、 CuSO 4 D . O 2 、 Si |
|
| 16. | 详细信息 |
|
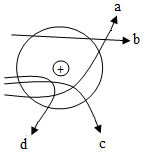
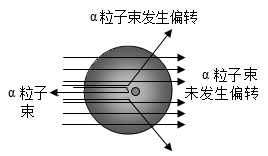
卢瑟福的 α 粒子 ( 带正电 ) 轰击金箔实验,推翻了汤姆森在 1903 年提出的原子结构模型,为现代原子理论打下了基础。下图线条可能是 α 粒子在该实验中运动轨迹的是( ) A . bcd B . abc C . acd D . abcd |
|
| 17. | 详细信息 |
|
植被丰富的公园中有丰富的负氧离子,空气中氧分子得到电子就能形成负氧离子( A . B . C . D . |
|
| 18. | 详细信息 |
|
科学家发现一种只有四个中子构成的粒子,有关该粒子的说法正确的是 A . 不显电性 B . 失去一个中子后显 +1 价 C . 相当于两个氦 (He) 原子的质量 D . 在现有的周期表中不可能有它的位置 |
|
| 19. | 详细信息 |
|
下图为 A 、 B 、 C 、 D 是四种微粒的结构示意图。 (1)A 、 B 、 C 、 D 中属于阴离子的是 ____ ( 填微粒符号 ) ;其中 D 微粒最外层电子数 x = ____ 。 (2)A 、 B 、 C 、 D 中属于同种元素的微粒是 _____ ( 填字母序号 ) 。 (3)A 微粒的化学性质与 B 、 C 、 D 中哪一种微粒的化学性质相似? ____ ( 填字母序号 ) 。 (4) 具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。下列各组微粒中属于等电子体的是 _____ ( 填字母序号 ) 。 A NO 和 O 2 B CO 和 N 2 C SO 2 和 NO 2 |
|
| 20. | 详细信息 |
|
用 “ > ”、“ < ”或“ = ”填空: ( 1 )微粒的质量,一个电子的质量 _______ 一个质子的质量, ( 2 )相同条件下,氧气的沸点 _______ 氮气的沸点, ( 3 ) 1 个钠离子中的电子数 ________ 1 个钠原子中的电子数, ( 4 )量取 10mL 的水时仰视读数量得的液体 _______ 视线与凹液面的最低处保持水平时读数量到的液体。 |
|
| 21. | 详细信息 |
|
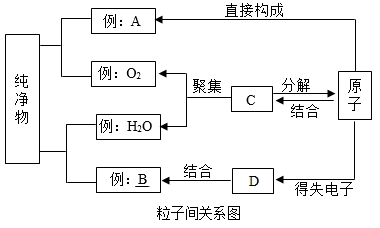
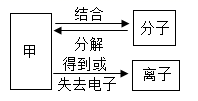
在宏观、微观和符号之间建立联系是化学学科的特点。 (1) 上图中甲是 _______________ 。 (2) 在 ① 汞 ② 氮气 ③ 氯化钠 ④ 水 ⑤ 二氧化碳五种物质中,由原子构成的是 _______________ ,由离子构成的是 __________________ 。 ( 填序号 ) |
|
| 22. | 详细信息 |
|
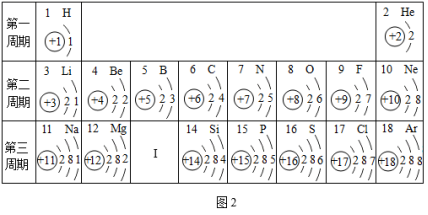
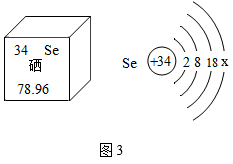
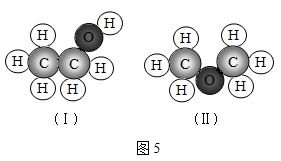
微观粒子看不见、摸不着,化学之初,人们通过模型来说明他们心目中粒子的 “模样”,揭示物质的微观结构特点,解释微观结构与宏观现象之间的因果关系。模型化的方法是化学科学重要的思想工具,试回答下列问题 : ( 1 )原子的结构 一百多年来,化学借助构建原子结构模型,逐渐揭开了原子构成的神秘面纱,并通过不断提出新的原子结构模型,逐步形成了今天的原子结构理论。如图 1 两种模型是汤姆森和卢瑟福分别于 1897 年和 1911 年提出的,其中 ________ ( 填代号 ) 是由卢瑟福提出的。 这种模型也可以抽象为原子结构示意图,如图 2 所示,这是核电荷数 1~18 元素在元素周期表中的相关信息,请利用图表中的信息回答相关问题 : ① 请画出 Ⅰ处原子的原子结构示意图 ______ ,该元素的原子在化学反应中易 ______ ( 填 “得到”或“失去” ) 电子,所以该元素与氯元素形成的化合物的化学式为 _______ 。 ②图 2 中具有相似化学性质的元素是 _______ 。 A Be 和 Mg B O 和 S C Be 和 He D He 和 Ne ③硒元素能够增强人体免疫力,是人体必需的营养元素。晒元素的相关信息如图 3 所示,则 x= ______ ,该元素应该位于元素周期表中 _______ 元素的正下方 ( 填元素符号 ) 。 ( 2 )离子的结构 在初中化学中,离子的结构可以用离子结构示意图来表示。 . 在如图 4 中 : 属于阳离子的是 ( 填代号下同 ) _______ ,属于阴离子的是 _________ 。 ( 3 )分子的结构 如图 5 中 ( Ⅰ ) 和 ( Ⅱ ) 分别是两个分子的微观结构模型,你认为它们所代表的物质的化学式是否相同 ? _______ .( 填 “是”或“否”,下同 ) 二者是否为同一种物质 ? _______ 。 |
|
| 23. | 详细信息 |
|
有下列六种微粒的结构示意图: 回答下列问题: ( 1 )上述微粒共表示 ______ 种元素。 ( 2 )上述六种微粒中,化学性质相似的两种原子是 ______ (填序号)。 ( 3 )写出 C 表示的微粒符号 _______ 。 |
|
| 24. | 详细信息 |
|
根据图文回答问题。 请在 A 、 B 处填入合适的物质的化学式, C 、 D 处填入粒子类型(填 “分子”“原子”或“离子”): A ________ ; B ________ ; C ________ ; D ________ 。 |
|
| 25. | 详细信息 | ||||||||||||||||||
|
下表列出几种原子的质量和相对质量,根据要求计算。试求:
( 1 )通过计算填写上述表格两处空白。(钙的相对质量结果保留整数,氢原子的实际质量结果保留为 0.1×10 -27 kg ) ( 2 )计算水、二氧化碳的化学式量 _____ ; _____ ; ( 3 )根据以上数据,对下列情况做出比较。 ①相同质量的钙和铁,其中铁原子数目 _____ 钙原子数目(填写 “ > ”、“ < ”或“ = ”,下同); ②相同质量的水和二氧化碳,其中水分子数目 _____ 二氧化碳分子数目。 |
|||||||||||||||||||
| 26. | 详细信息 |
|
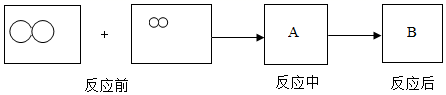
认识物质的组成,并从微观的角度来了解物质的构成和化学反应,都是重要的学习化学的方法。 ( 1 )从宏观组成的角度看,氯化钠由 _____ 组成;从微观的角度看,氯化钠由 _____ (写微粒名称)构成。 ( 2 )水蒸发为水蒸气,所占体积变大,从分子角度看,是因为 ________ 。 ( 3 )下图表示氢气与氯气反应的微观过程(图中大圆圈表示氯原子,小圆圈表示氢原子)。 ①请在 A 、 B 中画出相应的微观粒子图 _______ 。 ②该反应所属基本反应类型是 _______ 。 |
|
| 27. | 详细信息 |
|
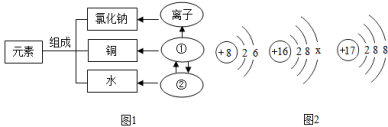
在宏观、微观和符号之间建立联系是化学学科的特点。 ( 1 )物质的组成构成关系如图 1 所示,图中 ①表示的是 _____ , ②表示的是 _____ ; ( 2 )图 2 是氧、硫、氯三种元素的原子结构示意图 ①硫原子的结构示意图中 x 的数值是 _____ , ②氧和硫两种元素的化学性质具有相似性的原因是它们原子的 _____ 相同, ③氧和氯两种元素最本质的区别是它们原子中的 _____ 不同。 |
|
| 28. | 详细信息 |
|
( 1 )将 “分子”、“原子”、“元素”填入如图序号所对应的横线上。 ① _____ ② _____ ③ _____ 。 |
|
| 29. | 详细信息 |
|
规范的实验操作是实验成功的前提,请回答: ( 1 ) A 、 B 、 C 、 D 表示四种物质,其微观示意图如图所示: ( 2 )试管等玻璃玻璃仪器刷洗干净的标准是 ____________ 。 ( 3 )做 “硫在氧气里燃烧”的实验时,要在集气瓶中预先装少量的水,其目的是 ______________ 该反应既是 _______ 反应,又是 ________ 反应. ( 4 )做细铁丝在氧气中燃烧的实验时,集气瓶底应预先加入少量 __________ ;目的是 _______________ 。 ( 5 )若一个原子的相对原子质量为 m, 一个作标准的碳原子的质量为 nkg ,则该原子的质量为 __________ 。 |
|
| 30. | 详细信息 |
|
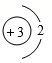
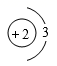
如图为某粒子的结构示意图,请回答下列问题。 ( 1 )若 m=13 ,则该粒子所对应的元素符号为 _____ ; ( 2 )若 m=17 , n=8 ,则该粒子是 _____ (填序号)。 ① 原子 ② 阳离子 ③ 阴离子 ( 3 )若该粒子处于稳定状态,且带两个单位的负电荷,则该粒子的化学符号为 _____ ; ( 4 )若该粒子是原子,且化学性质与氮元素的原子化学性质相似,则 m=_____ 。 |
|
| 31. | 详细信息 |
|
构成物质的粒子之间的关系如图所示。 ( 1 )甲是 _____ 。 ( 2 )氧气、汞和氯化钠三种物质中,由离子构成的是 ____ 。 ( 3 )某粒子的结构示意图如图。 ① 当 a = ____ 时,该粒子是原子。 ② 当 a = 11 时,该粒子是 ____( 填 “ 阳离子 ” 或 “ 阴离子 ”) 。 |
|
| 32. | 详细信息 |
|
化学从分子、原子层面,研究物质的组成、构成、性质和发生变化的奥秘。 ( 1 )如图是氢、氧、氯原子的结构示意图: ①氢原子核内质子数为 _____ 。 ②氧元素在周期表中排在第 _____ 周期; ③氯原子在化学反应中易 _____ 电子(选填 “得到”或“失去”)。 ( 2 )某化学反应的微观模拟示意图如下: ①写出 C 物质的化学式 _____ 。 ② A 、 B 、 C 、 D 四种物质中,属于氧化物的是 _____ 。(填序号) ③该微观模拟示意图可知,化学反应前、后没有发生变化的粒子是 _____ 。 |
|
| 33. | 详细信息 |
|
建立宏观、微观和符号之间的联系是化学学科的特点。请根据图中信息回答下列问题: ( l )图一中,直接由分子构成的物质是 ______ (填化学用语,下同); ( 2 )直接由离子构成的物质是 ______ ,其中的阳离子是 ______ ,阴离子是 ______ ;图二如果是表示此阴离子的结构示意图,则其中数字 x 应是 ______ 。 |
|
| 34. | 详细信息 |
|
如图是铈元素在元素周期表中的信息以及 A 、 B 、 C 、 D 四种粒子的结构示意图,请根据图示回答:铈元素的原子核外电子数是 ___________ ; B 、 C 属于不同种元素的原因是 ____________ ; A 、 B 、 C 、 D 四种粒子中具有相对稳定结构的是 __________ (填字母)。 |
|
| 35. | 详细信息 |
|
溴的原子结构示意图如图所示,试回答: ( 1 ) X 的值为 ______ ; ( 2 )溴元素的化学性质与下列哪种元素的化学性质最相似 ______ (填序号)。 |
|
| 36. | 详细信息 |
|
镓是一种奇妙的金属,放在手心马上熔化,犹如荷叶上的水珠。请阅读上述信息后回答: ①镓原子结构示意图中 X 的数值为 _______ ; ②镓原子和镓离子的化学性质 _______ ( 填 “ 相同 ” 或 “ 不同 ”) 。 |
|
| 37. | 详细信息 |
|
按要求填空。 (1) 用化学用语填空: ①保持氮气化学性质最小粒子 _______ ; ②天然气的主要成分是 _______ ; (2) 诗云 “ 满架蔷薇一院香 ” ,从微观角度分析能闻到一院花香的原因是 _______ 。 |
|
| 38. | 详细信息 | ||||||||||||||||||||||||||||||
|
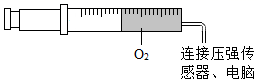
今年 5 月 5 日成功首飞的长征五号 B 运载火箭,采用了低温高压液氢作燃料。 (1) 构成氢气的微观粒子是 _______ 。 (2) 从微观的角度分析,氢气变成液氢时发生变化的是 _______ 。 (3) 如图所示,将一定量氧气封闭在注射器中,改变氧气的体积和温度,记录不同条件下注射器中氧气的压强大小,结果如图。
分析数据可知,其他条件不变:温度升高,气体压强 _______ ;体积增大,气体压强 _______ 。 (4) 影响一定容积的氧气钢瓶内压强大小的因素是瓶内的温度、 _______ 。 |
|||||||||||||||||||||||||||||||
| 39. | 详细信息 | |||||||||||||||||||||
|
如图是四种粒子的结构示意图和元素周期表的一部分。请回答:
( 1 )图中 A 、 B 、 C 、 D 中表示阴离子的是 _____ (填序号)。 ( 2 ) D 中 x = _____ 。 ( 3 ) A 元素的原子在化学反应中 _____ 电子(填 “易得”、“易失”或“不得不失”)。 ( 4 ) A 、 B 、 C 、 D 四种粒子中,不具备稳定结构的是 _____ (填序号)。 ( 5 )由表中原子序数为 1 、 8 、 13 的元素组成物质的化学式为 _____ 。 |
||||||||||||||||||||||
| 40. | 详细信息 |
|
人们为揭示原子结构的奥秘,经历了漫长的探究过程。 ( 1 )英国科学家道尔顿最先确立了原子学说,他的中心论点主要有: ①原子是不能再分的粒子;②原子是微小的实心球体;③同种元素的原子,其性质和质量都相同。按照目前你所学的原子结构的理论,你认为道尔顿的三个论点中,不确切的是 ______ (填数字序号)。 ( 2 ) 1911 年著名物理学家卢瑟福等人为探索原子的内部结构又进行了实验。他们在用一束带正电的、质量比电子大得多的高速运动的 a 粒子轰击金箱时发现: ①大多数 a 粒子能穿透金箱而不改变原来的运动方向,说明了 ______ ; ②少部分 a 粒子改变原来的方向,原因是这些 a 粒子途经金原子核附近时受到 ______ (填 “吸引”或“排斥”)而稍稍改变了运动方向; ③极少数 a 粒子被反弹回来,原因是 a 粒子的质量远远 ______ (填 “大于”或“小于”)金原子核的质量。 ( 3 )原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,科学家们运用了 ______ 来表达他们的理论成果。 |
|
| 41. | 详细信息 |
|
M 元素常为骨质疏松患者需补充的元素,其原子结构示意图为: (1)X 的值是 __ , M 元素属于 __ ( 填 “ 金属 ” 或 “ 非金属 ”) 元素,它容易 ___ 电子,形成 __ ( 填 “ 阴 ” 或 “ 阳 ”) 离子. (2) 下列微粒结构示意图中属于离子的是 __ ( 填序号 ) ,其符号可表示为 _____ ,根据 “ 结构决定性质 ” 的观点, M 元素的化学性质与下列 __ ( 填序号 ) 元素的化学性质相似. |
|
| 42. | 详细信息 |
|
已知某粒子 A 2+ 的核外电子数为 10 ,相对原子质量为 24 ,则该粒子的质子数为多少?中子数为多少?(直接写出结果) |
|
| 43. | 详细信息 |
|
俄罗斯科学家最近合成了核电荷数为 139 元素的原子,经测定该原子质量为 4.89946 × 10 -26 kg( 已知碳原子质量为 1.993 × 10 -26 kg) 计算: (1) 该原子的相对原子质量是多少? ( 只列出计算式子 ) (2) 若测定该原子相对原子质量是 295 ,则该原子中子数为多少?中子数和电子数只差为多少? |
|
| 44. | 详细信息 |
|
有关原子的计算。 ( 1 )等质量的镁与铁中,所含原子的个数之比为 _____ 。 ( 2 )某 R 原子的实际质量为 a 克,一个碳 -12 原子的实际质量为 b 克,则 R 原子的相对原子质量为 _____ 。 |
|
| 45. | 详细信息 |
|
已知作为相对原子质量标准的一种碳原子的质量是 1.993 × 10 -26 kg 。 ( 第 (1) 和 (2) 要求写出计算过程 ) (1) 若一个铝原子的质量是 4.482 × 10 -26 kg ,则铝原子的相对原子质量是多少?已知在铝原子核中有 13 个质子,则铝原子中的中子数是多少? (2) 若氧原子的相对原子质量是 16 ,则一个氧原子的质量是多少? (3) 相同质量的锂和铝, ___________ 含有的原子个数更多。 |
|
| 46. | 详细信息 |
|
构成物质的微粒有哪些?请分别举例说明。 ________ |
|
| 47. | 详细信息 |
|
人们为了揭示原子结构的奥秘,经历了漫长的探究过程。 1911 年英国科学家卢瑟福用一束质量比电子大很多的、带正电的高速运动的 α 粒子轰击金箔时,出现了如图所示的现象:请你根据对原子结构的认识,分析出现上述卢瑟福实验现象的原因: ① 大多数 α 粒子能顺利穿过金箔,说明原子 ______________ 。 ② 一部分 α 粒子穿过金箔,但是改变了原来的运动方向,原因 ____________ 。 ③ 极少数 α 粒子被反弹过来,原因 _____________ 。 |
|
| 48. | 详细信息 |
|
科学理论的建立与发展是一代代科学家不懈努力的结果。人们对物质构成的认识,经历了漫长的探索过程。 ( 1 )原子的构成:汤姆森、卢瑟福等科学家都是根据实验证据进行推理,再用原子模型来表征原子的内部结构。 ① 汤姆森之前,科学家对原子的认识是原子是构成物质的最小粒子,不可再分。 1897 年,汤姆森在实验中发现所有原子都能释放出一种带负电的粒子,这种粒子就是 _____ 。如果你在当时的实验现场,根据这一实验结果,你推理获得的结论有 _____ 、 _____ 。 ② 卢瑟福等科学家在汤姆森研究的基础上,根据 a 粒子轰击金箔实验结论,提出了原子的核式(有核行星)模型。 ③ 在化学变化中,构成原子的微粒 _____ 不变, _____ 可变。 ( 2 )分子的构成:十九世纪初,科学家们提出早期的分子学说,部分观点如下: 观点 1 :一切物质都是由分子构成,分子是由原子构成。 观点 2 :单质分子由相同种类原子组成,化合物分子由不同种类原子组成。 根据以上材料回答问题: ①按现代分子理论,观点 1 是否正确? _____ 。 ②从元素角度谈谈你对观点 2 的认识 _____ 。 ( 3 )万物皆原子,原子是构成一切化学物质的基本单元。如图是氢、氖、钠和氯的原子结构示意图: 请你以氖气、氯化氢两种物质为例,从原子直接或间接构成物质的角度,简要谈谈你对 “原子是构成一切化学物质的基本单元”的理解。 ①氖气 _____ ; ②氯化氢 _____ 。 |
|
| 49. | 详细信息 |
|
人类对原子的认识 公元前 5 世纪古希腊学者曾指出:万物是由极其微小的、不可分割的微粒 ——“原子”构成的;中国古代哲学家墨子指出:“非半弗,则不动,说在端”,意思是说“不能分成两半的东西是不能砍开的,也就对它不能有所动作,它便是端了”; 1803 年,英国科学道尔顿借用 “原子”概念,创立原子论:一切物质都是由原子构成,原子很小,呈圆球状、不可再分; 1811 年,意大利科学家创立分子学说,指出:有些物质也是由分子构成; 1897 年,英国科学家汤姆生通过实验发现了电子; 1911 年英国科学家卢瑟福用一束带正电荷的 a 粒子轰击金箔,发现了原子核; 1919 年,卢瑟福和他的助手在实验中发现了质子; 1932 年,经过科学家们的反复实验发现了中子; 20 世纪 80 年代中期,人们借助扫描隧道显微镜观察到原子在物质表面的排列状况。 ( 1 )下列哪些物质由原子直接构成的 _______ (填序号)。 A 水( H 2 O ) B 二氧化碳( CO 2 ) C 金刚石( C ) D 氯化钠( NaCl ) ( 2 )材料中能够纠正道尔顿的原子论中 “原子不可再分”这一观点的科学事实是 ______ ;实验室用过氧化氢和二氧化锰混合制氧气的反应可以说明分子在化学变化中可分,请写出反应的文字表达式 ___________ ,该反应所属的反应类型是 _______ 。 ( 3 )下列有关人类对原子结构的认识中,说法正确的是 _______ . A 扫描隧道显微镜可确定原子的真实存在 B 扫描隧道显微镜可以观察到原子的内部结构 C 科学模型的建立是一个不断完善、不断修正的过程 D 人类借助模型的建立,对原子的认识逐渐接近本质 |
|
| 50. | 详细信息 |
|
下列事实的解释合理的是 ( ______ ) A . 6000L 氧气加压时能装入 40L 的钢瓶中 ——加压时,分子体积减小 B .氮气常用做保护气 ——氮气化学性质稳定 C .活性炭能除去水中的色素 ——活性炭能与色素发生化学反应 D . CO 与 CO 2 组成元素相同,但化学性质不同 —— _____ |
|