2018高三上学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
纵观古今,化学与生活皆有着密切联系。下列有关说法错误的是( ) A. “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同 B. 制作烟花的过程中常加入金属发光剂和发色剂使烟花放出五彩缤纷的颜色 C. 草莓棚中使用的“吊袋式二氧化碳气肥”的主要成分可以是碳酸钙 D. 《本草纲目》记载的“凡酸坏之酒,皆可蒸烧”的实验方法可用来分离乙酸和乙醇 |
|
| 2. | 详细信息 |
|
下列有关物质分类或归类中,正确的是( ) ①混合物:盐酸、漂白粉、氯水、水银 ②化合物:CaCl2、NaOH、HCl、HD ③电解质:明矾、生石膏、冰醋酸、氯化银 ④同素异形体:C60、C70、金刚石、石墨 A.①③ B.②③ C.③④ D.④ |
|
| 3. | 详细信息 |
|
下列实验操作和数据记录都正确的是( ) A. 用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2 g B. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.30 mL C. 用干燥的广泛pH试纸测稀盐酸的pH=5.1 D. 用10 mL量筒量取NaCl溶液,体积为6.5 mL |
|
| 4. | 详细信息 |
|
LiBH4是有机合成中常用的试剂,与水反应:LiBH4+2H2O=LiBO2+4H2↑(LiBH4中B为+ 3价),下列说法中正确的是( ) A. LiBH4被氧化,LiBO2是氧化产物 B. 生成lmolH2,反应转移2mol电子 C. LiBH4与D2O反应,生成的气体相对分子质量为3 D. 与LiBH4中Li、H化合价相同的两种离子的半径Li>H |
|
| 5. | 详细信息 |
|
下列离子方程式书写不正确的是( ) A. A1C13 溶液与烧碱溶液反应,当n(OH-) :n(A13+)=7 : 2 时, 2A13++7OH-==A1(OH)3↓+ AlO2-+2H2O B. 当向饱和Na2CO3溶液中通入过量CO2时,CO32-+CO2 + H2O==2HCO3- C. CuCl2 溶液与 NaHS 溶液反应,当n(CuCl2):n(NaHS) = l : 2 时, Cu2++2HS-==CuS↓十H2S↑ D. Fe 与稀硝酸反应,当 n(Fe) : n(HNO3)=l : 2 时,3Fe+2NO3-+8H+==3Fe2+ +2NO↑+4H2O |
|
| 6. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确有( )个 ①常温常压下,28gC2H4和C4H8的混合物中一定含有6NA个原子 ②0℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有2NA个电子转移 ③常温下,pH=12的氢氧化钠溶液中OH-数目为0.01NA ④1L1.0mol/LFeCl3溶液全部水解制备氢氧化铁胶体,所得氢氧化铁胶体数目为NA ⑤同温同压下,O2和CO混合气体密度是氢气的15倍,则O2和CO的体积比1:1 ⑥常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA ⑦lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 ⑧100克质量分数为46%的乙醇溶液中,含有的氧原子数目为NA ⑨标准状况下,22.4LHF气体中含有NA个气体分子 A. 4 B. 1 C. 2 D. 3 |
|
| 7. | 详细信息 |
|
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO ① 取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液; ② 在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲; ③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。 根据对上述实验的分析判断,最后得出的结论合理的是( ) A.不能判断溶液中是否存在SO42- B.溶液中一定不存在的离子是CO32- C.不能判断溶液中是否存在Ag+ D.不能判断是否含有 AlO |
|
| 8. | 详细信息 | ||||||||||||||||||||
|
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
|
|||||||||||||||||||||
| 9. | 详细信息 |
|
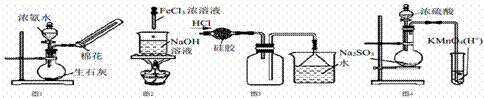
下列有关实验装置进行的相应实验, 能达到实验目的的是( )
A. 利用图 1 所示装置制取少量 NH3 B. 利用图 2 所示装置制备 Fe(OH)3 胶体 C. 利用图 3 所示装置收集 HCl D. 利用图 4 所示装置检验 SO2 的漂白性 |
|
| 10. | 详细信息 |
|
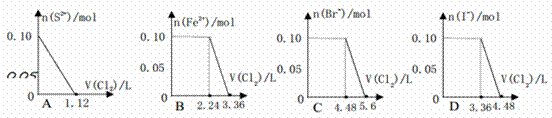
.向含 S2-、 Fe2+、 Br -、 I-各 0.1 mol 的溶液中通入 Cl2, 通入 Cl2 的体积(标准状况) 和溶液中相关离子的物质的量的关系图正确的是( )
|
|
| 11. | 详细信息 | |||||||||||||||||||||
|
用如图所示装置及表中的药品(装置I中的试剂足量)并依据装置Ⅱ中的现象,检验混合气体中的某种成分,方案合理的是( )
|
||||||||||||||||||||||
| 12. | 详细信息 |
|
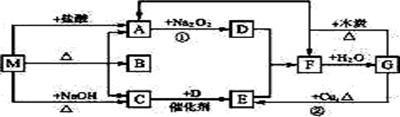
下图的每一方格中表示有关的一种反应物或生成物,其中A、C、D、E为无色气体,F为红棕色气体。下列说法不正确的是( )
A.M可能是纯净物或混合物 B.用蘸有浓盐酸的玻璃棒靠近瓶口可以检验C气体是否收集满了 C.F与水的反应中氧化剂与还原剂的物质的量之比为2∶1 D.D在一定条件下可以与C发生置换反应 |
|
| 13. | 详细信息 |
|
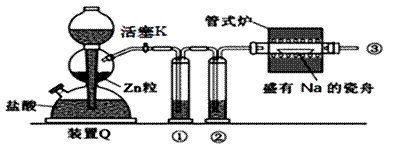
.实验室用 H2 和钠反应制备氢化钠的装置如右图所示(Zn 粒中含有少量 ZnS 杂质), 下列说法不正确的是( )
A. ①、 ②中依次盛有浓 NaOH 溶液、 浓 H2SO4 B. 管式炉加热前, 用试管收集③处气体并点燃, 通过声音判断气体纯度 C. 结束反应时, 先停止管式炉加热, 再关闭活塞 K D. 取出瓷舟内的固体, 投入适量水中, 若有气体产生, 即可证明制得了氢化钠 |
|
| 14. | 详细信息 |
|
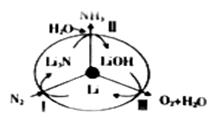
.最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。下列说法正确的是( ) A. Li在实验室用煤油密封保存 B. 反应Ⅲ中能量转化的方式化学能转变为电能 C. 图中反应Ⅱ的化学方程式 Li3N+3H2O=3LiOH+NH3↑ D. LiOH的碱性比NaOH强 |
|
| 15. | 详细信息 |
|
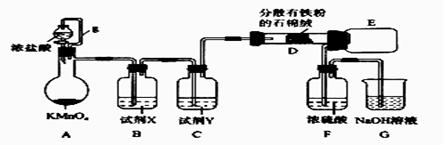
FeCl3易潮解、易升华,实验室制备FeCl3的装置如图所示(加热和夹持装置略去)。下列说法正确的是( )
A. 导管g的作用是增强装置的气密性 B. 试剂X和试剂Y分别为浓硫酸、饱和食盐水 C. 直接用E接收产物比用导管连接的优点是可防止堵塞 D. F中浓硫酸的作用是防止空气中的水蒸气进入E |
|
| 16. | 详细信息 |
|
硫的多种化合物在工业中有重要应用。 (1)Na2S2可以做制革工业中原皮的脱毛剂,写出Na2S2的电子式______________。 (2)连二亚硫酸钠(Na2S2O4)又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。 ①Na2S2O4中S元素的化合价为_____________ ②将甲酸(HCOOH)和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2,该反应的化学方程式为_________________。 ③Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1:2时,反应的化学方程式为____________。 (3)铬会造成环境污染,某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg/L,达到排放标准。 ①写出Na2S2O5参加反应的离子方程式_______________________。 ②处理后的废水中Cr3+的物质的量浓度为____________________。 |
|
| 17. | 详细信息 |
|
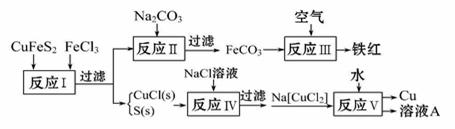
黄铜矿(CuFeS2)是冶炼铜及制备铁氧化物的重要矿藏,常含有微量金、银等。下图是以黄铜矿为主要原料生产铜、铁红(氧化铁)颜料的工艺流程图:
(1)CuCl难溶于水,但可与过量Cl-反应生成可溶于水的[CuCl2]-,该反应的离子方程式为________________________________。 (2)有大量Cl-存在时,Na2SO3可将CuCl2还原成[CuCl2]-,因此Na2SO3要缓慢滴入到溶液中的原因是_______________________________。 (3)反应I〜V中,属于非氧化还原反应的是反应_______________________。 (4)已知反应V中Cu+发生自身氧化还原反应,歧化为Cu2+和Cu,由此可推知溶液A中的溶质为________________(填化学式)。 (5)在酸性、有氧条件下,一种叫做Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程中发生反应的离子方程式为_____________________________。 (6)将一定量铁红溶于160 mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束后共收集气体2.24L(标准状况下),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________________g。 |
|
| 18. | 详细信息 | ||||||||||||
|
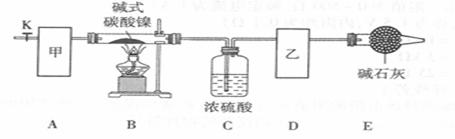
碱式碳酸镍[Nix(OH)y(CO3)z·nH2O是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。为确定其组成,某同学在实验室中进行了有关的实验探究。回答下列问题:
(l)甲、乙两装置可分别选取下列装置______、_______(填字母,装置可重复选取)。
(2)称取一定量的碱式碳酸镍样品,放入硬质玻璃管内;安装好实验仪器,检查装置气密性;加热硬质玻璃管,当装置C中__________(填实验现象)时,停止加热;打开活塞K,缓缓通入空气。其目的是_______________________。 (3)装置A的作用是_________,装置E的作用是_____________。 (4)实验前后测得下表所示数据:
已知碱式碳酸镍中Ni化合价为+2价,则该碱式碳酸镍的化学式为___________。 (5)采取上述实验装置进行该实验时,必须小心操作,且保证装置气密性良好,否则浓硫酸倒吸,可导致加热的硬质玻璃管炸裂。为防止浓硫酸倒吸入硬质玻璃管中,提出你的改进措施:______________________。 |
|||||||||||||
| 19. | 详细信息 |
|
二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+; ②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。 回答下列问题: (1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是__________________。 (2)“萃取”时存在反应:Ce4+ +n(HA)2
(3) “反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作__________________ (填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________________。 (4)“氧化”步骤的化学方程式为 ___________________ 。 (5)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为__________________。 |
|
| 20. | 详细信息 |
|
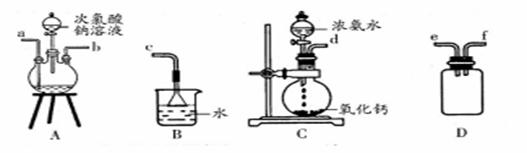
肼(N2H4)是一种高能燃料,常温下为无色具有强烈的吸水性的有毒液体。熔点(2℃), 沸点(113.5℃)N2H4水溶液的碱性弱于氨水;N2H4有强还原性。化学小组同学在实验室中用过量NH3和NaC1O溶液反应制取N2H4并探究其性质。回答下列问题:
(1)A中反应容器的名称为 (2)用上图装置制取肼,其连接顺序为________(按气流方向,用小写字母表示)。 (3)装置A中生成N2H4·H2O,则发生反应的化学方程式为_________________,装置D的作用是_______________。 (4)用化学用语解释N2H4水溶液呈碱性的原因: (5)解释在锅炉水中加入肼可以保护铁制锅炉的原因: (6)将A中得到的粗产品和烧碱混合,逐渐通入氮气以除空气,目的为 加热至碱液温度近110℃,待烧碱完全溶解后,冷却到60℃左右,进行 至蒸馏液含肼量90%~94%,再经分馏、除去水分后,冷凝,制得98%~99.5%的无水肼。则空白处应填写( ) A.加压蒸馏 B.常压蒸馏 C.真空蒸馏 |
|