2018吉林高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列化学用语表示正确的是 A、 甲烷的球棍模型: C、 HF的电子式:H∶F D、 次氯酸结构式:H-Cl-O
|
|
| 2. | 详细信息 |
|
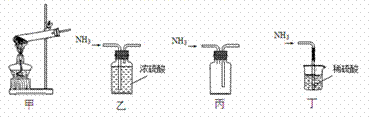
实验室用NH4Cl固体和Ca(OH)2固体反应制备NH3,下列装置能达到相应实验目的的是
A、 装置甲:制备NH3 B、 装置乙:干燥NH3 C、 装置丙:收集NH3 D、 装置丁:吸收多余NH3
|
|
| 3. | 详细信息 |
|
有9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2.24 L。将溶液稀释为IL,测得溶液的pH=l,此时溶液中NO3—的浓度为 A、 0.3 mol/L B、 0.4 mol/L C、 0.5 mol/L D、 0.6 mol/L
|
|
| 4. | 详细信息 |
|
设NA为阿伏伽德罗常数的值,下列叙述正确的是 A、 25℃、l0IKPa下,NA个C18O2分子的质量为48g B、 标准状况下,22.4L HF中含有的电子数为10NA C、 1mol白磷(P4)分子中所含化学键的数目为4NA D、 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA
|
|
| 5. | 详细信息 |
|
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。NaH2PO2为正盐,可将溶液中的Ag+还原为Ag,从而可用于化学镀银。利用NaH2PO2进行化学镀银反应中,若氧化剂与还原剂的物质的量之比为4:1,则氧化产物的化学式为 A、 H3PO4 B、 Na3PO4 C、 Ag D、 Na2HPO2
|
|
| 6. | 详细信息 |
|
化学无处不在,下列与化学有关的说法错误的是 A. 塑料、合成纤维、合成橡胶主要是以石油、煤和天然气为原料生产的 B. 利用丁达尔效应可以提纯混有葡萄糖的稀淀粉溶液 C. 氨气、二氧化碳、乙醇都属于非电解质 D. 硫氧化物和氮氧化物是形成酸雨的主要物质
|
|
| 7. | 详细信息 |
|
下列离子方程式书写正确的是 A、 Na与水反应:2Na+2H2O=2Na++2OH-+H2↑ B、 FeCl3腐蚀电路板:Fe3++Cu=Fe2++Cu2+ C、 向Mg(OH)2中加入盐酸:OH-+H+=H2O D、Cl2与水反应:Cl2+H2O=2H++Cl-+ClO-
|
|
| 8. | 详细信息 |
|
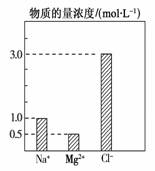
在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是
A、NaCl的物质的量为0.1mol B、该混合液中BaCl2的物质的量为0.05mol C、溶质MgCl2的质量为9.5 g D、将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量的浓度为0.1mol/L
|
|
| 9. | 详细信息 |
|
将O2和NH3的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的水,最终收集到44.8mL O2。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况) A. 134.4mL B. 313.6mL C. 287.5mL D. 268.8mL
|
|
| 10. | 详细信息 |
|
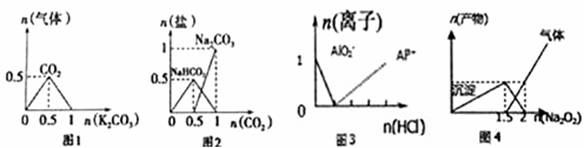
.下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol)
A. 图1: n (HCl)=1mol,K2CO3加入到HCl溶液中,在敞口容器中生成的气体 B. 图2 : n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐 C. 图3 :n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况 D. 图4 : n(AlCl3)=1mol, Na2O2加入AlCl3溶液反应的产物
|
|
| 11. | 详细信息 |
|
A.1:1:1 B.1:3:1 C.3:3:8 D.1:1:4
|
|
| 12. | 详细信息 |
|
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量OH−外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。试问原混合气体中Cl2与HCl体积比为 A.2:5 B.3:1 C.5:2 D.1:1
|
|
| 13. | 详细信息 |
|
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体; 向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中 A、至少存在5种离子 B、Cl-一定存在,且c(Cl‑)≥0.4mol/L C、SO42-、NH4+、一定存在,Cl-可能不存在 D、CO32-、Al3+一定不存在,K+可能存在
|
|
| 14. | 详细信息 |
|
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
己知:Zn及其化合物的性质与Al及其化合物的性质相似。下列相关说法错误的是 A、 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层 B、. 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO C、 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化 D、 Fe3O4胶体粒子能用减压过滤法实现固液分离
|
|
| 15. | 详细信息 |
|
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是 A、 生成42.0LN2(标准状况) B、 有0.250molKNO3被氧化 C、 转移电子的物质的量为2.25mol D、 被氧化的N原子的物质的量为3.75mol
|
|
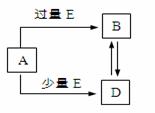
| 16. | 详细信息 |
|
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如下图所示(部分产物略去),则下列有关物质的推断不正确的是
A.若A是铁,则E可能为稀硝酸 B.若A是CuO,E是碳,则B为CO C.若A是NaOH溶液,E是CO2,则B为NaHCO3 D.若A是AlCl3溶液,E可能是氨水
|
|
| 17. | 详细信息 |
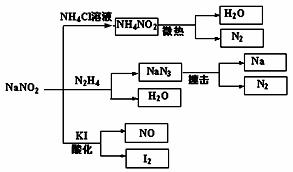
|
.亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见下图,下列说法错误的是
A.上图所涉及到的化学反应都是氧化还原反应 B.N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键 C.NaNO2与N2H4生成NaN3的反应方程式为:NaNO2 + N2H4 = NaN3 + 2H2O D.可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)
|
|
| 18. | 详细信息 |
|
向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴 滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化, 沉淀总物质的量n的变化如下图所示。则下列说法中正确的是 A.a点时溶液中所含主要溶质为(NH4)2SO4 B.a→b段发生反应的离子方程式是: SO C.b点为最大沉淀量,对应的纵坐标值为0.02 D.c点加入Ba(OH)2溶液的体积为200 mL
|
|
| 19. | 详细信息 |
|
下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的化合物是 ①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤Fe(OH)3 ⑥Fe2O3 A、 ①②③④ B、 ②③④ C、 ①③④⑤ D、 ①②④⑥
|
|
| 20. | 详细信息 |
|
下列物质的转化在给定条件下能实现的是 ① ③ ⑤ ⑥ A、 ①②⑤ B、 ②③⑥ C、 ②⑤⑥ D、 ①③④
|
|
| 21. | 详细信息 |
|
(一)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8 电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为________ _, (二)某工厂用 ①取少量废液,滴加KSCN溶液显红色。 ②取100mL废液,加入足量的 ③另取100mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了2.56g,再向反应后的溶液中滴加KSCN溶液不变色。根据探究实验得出结论: (1)废液中含有的金属离子是______________。 (2)100mL废液中Cl-的物质的量是___________________。 (3)原100mL废液中铜离子的物质的量浓度是_________________。
|
|
| 22. | 详细信息 | ||||||||||||||||
|
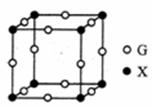
(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于__ __晶体,SeO2中Se原子采取的杂化类型为_____________。 (二)A、X、Y、Z、W、M、G等原子序数依次增大的前四周期元素
(1画出W基态原子的核外电子排布图___ (2)A 2Y的VSEPR模型名称为____ (3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理.写出X2Y的电子式____ (4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。 (5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为______cm。
|
|||||||||||||||||
| 23. | 详细信息 | ||||||
|
(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。
(1)反应过程中末端导管必须插入试管C的水中,目的是______。(填字母) A.吸收反应中剩余的氮气 B.控制通入气体的流速 C.防止空气中的氧气倒流进入反应装置,干扰反应 (2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
①通过计算得到化学式CaxN2,其中x=______。 ②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____________ ____, (二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题: (1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2 (2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________. (3)将一定量的Fe2O3溶于160mL 5mol•L﹣1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为___.
|
|||||||
| 24. | 详细信息 | |||||||||||||||
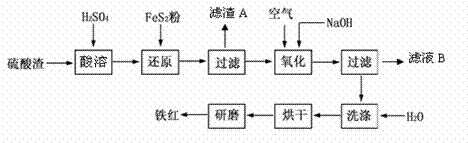
|
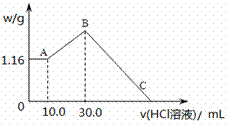
(一) 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO 等。现以硫酸渣制备铁红(Fe2O3),过程如下:
(1) 酸溶过程中Fe2O3与稀硫酸反应的离子方程式是_________________________。 (2) 还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:__________________________________________。 (3) 生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_ __。 (部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
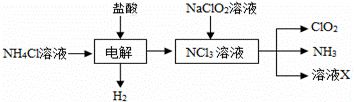
(1) 原混合物中NaOH的质量是________g。 (2) C点(此时沉淀恰好完全溶解)HCl溶液的体积为_________mL。 (三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。 实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
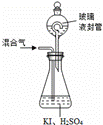
用右图装置可以测定混合气中ClO2的含量: I、在锥形瓶中加入足量的碘化钾,用50ml水溶解后,再加入3ml稀硫酸; II、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口; III、将一定量的混合气体通入锥形瓶中吸收; IV、将玻璃液封装置中的水倒入锥形瓶中; V、用0.1000 mol/L硫代硫酸钠标准溶液滴定锥形瓶中的溶液( ①测定混合器中ClO2的质量为_____________g ②用 A、.明矾 B、碘化钾 C、盐酸 D、硫酸亚铁
|
||||||||||||||||
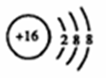
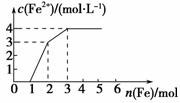 某稀溶液中含有
某稀溶液中含有