2018й«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺз”ҹжҙ»зҡҶжңүзқҖеҜҶеҲҮиҒ”зі»гҖӮдёӢеҲ—жңүе…іиҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В В пјү AпјҺз”ЁзәҜзўұе’Ңз”Ёжё…жҙҒеүӮйғҪиғҪжҙ—ж¶ӨзҺ»з’ғд»ӘеҷЁиЎЁйқўжІ№жұЎпјҢдҪҶеҺ»жұЎеҺҹзҗҶдёҚеҗҢгҖӮ BпјҺеҲ¶дҪңзғҹиҠұзҡ„иҝҮзЁӢдёӯеёёеҠ е…ҘйҮ‘еұһеҸ‘е…үеүӮе’ҢеҸ‘иүІеүӮдҪҝзғҹиҠұж”ҫеҮәдә”еҪ©зјӨзә·зҡ„йўңиүІ CпјҺиҚүиҺ“жЈҡдёӯдҪҝз”Ёзҡ„вҖңеҗҠиўӢејҸдәҢж°§еҢ–зўіж°”иӮҘвҖқзҡ„дё»иҰҒжҲҗеҲҶеҸҜд»ҘжҳҜзўій…ёй’ҷ DпјҺиҠ’зЎқжҷ¶дҪ“пјҲNa2SO4В·10H2OпјүзҷҪеӨ©еңЁйҳіе…үдёӢжӣқжҷ’еҗҺеӨұж°ҙгҖҒжә¶и§ЈеҗёзғӯпјҢжҷҡдёҠйҮҚж–°з»“жҷ¶ж”ҫзғӯпјҢе®һзҺ°дәҶеӨӘйҳіиғҪиҪ¬еҢ–дёәеҢ–еӯҰиғҪ继иҖҢиҪ¬еҢ–дёәзғӯиғҪ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗеҗҲдҪңеӯҰд№ е°Ҹз»„и®Ёи®әиҫЁжһҗпјҡ в‘ иҠұз”ҹжІ№еұһдәҺж··еҗҲзү©пјҢж¶Іж°ҜгҖҒеҶ°йҶӢй…ёеқҮеұһдәҺзәҜеҮҖзү© в‘Ўзўій…ёй’ гҖҒж°ўж°§еҢ–й’ЎгҖҒж°ҜеҢ–й“өйғҪеұһдәҺзҰ»еӯҗеҢ–еҗҲзү© в‘ўйҶӢй…ёгҖҒзғ§зўұе’ҢиҝҮж°§еҢ–й’ еҲҶеҲ«еұһдәҺй…ёгҖҒзўұе’ҢзўұжҖ§ж°§еҢ–зү© в‘Јж°Ёж°”гҖҒж°ҙе’ҢзЎ«й…ёй’ЎеҲҶеҲ«еұһдәҺйқһз”өи§ЈиҙЁгҖҒејұз”өи§ЈиҙЁе’Ңејәз”өи§ЈиҙЁ в‘Өз…Өзҡ„ж°”еҢ–дёҺж¶ІеҢ–еқҮеұһдәҺеҢ–еӯҰеҸҳеҢ–пјҢз…Өзҡ„е№ІйҰҸеұһдәҺзү©зҗҶеҸҳеҢ– в‘Ҙй…ёжҖ§ж°§еҢ–зү©дёҚдёҖе®ҡжҳҜйқһйҮ‘еұһж°§еҢ–зү©пјҢзўұжҖ§ж°§еҢ–зү©дёҖе®ҡжҳҜйҮ‘еұһж°§еҢ–зү© в‘Ұж°ўж°§еҢ–й“ҒгҖҒжңүиүІзҺ»з’ғе’ҢжһңеҶ»йғҪжҳҜиғ¶дҪ“ дёҠиҝ°иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ В В В В В пјү AпјҺв‘ в‘Ўв‘Јв‘ҘВ В В В В BпјҺв‘ в‘Ўв‘Јв‘ҰВ В В В CпјҺв‘Ўв‘ўв‘Јв‘ӨВ В В В DпјҺв‘ в‘Ўв‘ўв‘Ө
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°еҖјпјҢдёӢеҲ—жңүе…іеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В В В пјү AпјҺ1 molN2дёҺ4 mol H2еҸҚеә”з”ҹжҲҗзҡ„NH3еҲҶеӯҗж•°дёә2NA BпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2 L SO3дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°дёә1.5NA CпјҺ5.6g FeжҠ•е…Ҙ100 mL 3.5 mol/LзЎқй…ёдёӯпјҢе……еҲҶеҸҚеә”пјҢиҪ¬з§»з”өеӯҗжҖ»ж•°дёә0.3NA DпјҺйҖҡе…ҘдәҶ1 molCl2зҡ„ж–°еҲ¶ж°Ҝж°ҙдёӯпјҢHClOгҖҒClпјҚгҖҒC1OпјҚзІ’еӯҗж•°д№Ӣе’Ңдёә2NA
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
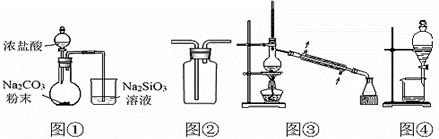
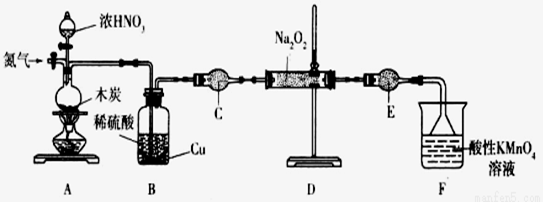
з”ЁдёӢеҲ—иЈ…зҪ®е®ҢжҲҗзӣёе…іе®һйӘҢпјҢеҗҲзҗҶзҡ„жҳҜпјҲВ В В В В пјүгҖӮ
AпјҺеӣҫв‘ пјҡйӘҢиҜҒH2CO3й…ёжҖ§ејәдәҺH2SiO3В В В В В В В В BпјҺеӣҫв‘Ўпјҡ收йӣҶCO2жҲ–NH3 CпјҺеӣҫв‘ўпјҡеҲҶзҰ»Na2CO3жә¶ж¶ІдёҺCH3COOC2H5В В В В DпјҺ еӣҫв‘ЈпјҡеҲҶзҰ»C2H5OHдёҺCH3COOC2H5
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғж—¶пјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨҹеӨ§йҮҸе…ұеӯҳзҡ„жҳҜпјҲВ пјү AпјҺ0.1molп№’L-1зҡ„AlCl3жә¶ж¶ІдёӯпјҡNa+гҖҒK+гҖҒCO32-гҖҒNO3-гҖҒ BпјҺpH=13зҡ„жә¶ж¶ІдёӯпјҡNa+гҖҒNH4+гҖҒCl-гҖҒNO3- CпјҺеңЁеҗ«жңүеӨ§йҮҸI-зҰ»еӯҗзҡ„жә¶ж¶ІдёӯпјҡClВҜгҖҒFe3пјӢгҖҒAl3пјӢгҖҒCu2пјӢ DпјҺcпјҲOH-пјү=1Г—10-13molп№’L-1зҡ„жә¶ж¶ІдёӯпјҡMg2+гҖҒK+гҖҒCl-гҖҒSO42-
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
AlNе№ҝжіӣеә”з”ЁдәҺз”өеӯҗгҖҒйҷ¶з“·зӯүе·ҘдёҡйўҶеҹҹгҖӮеңЁдёҖе®ҡжқЎд»¶дёӢпјҢAlNеҸҜйҖҡиҝҮеҸҚеә”Al2O3+N2+3C AпјҺAlNдёәж°§еҢ–дә§зү© BпјҺAlNзҡ„ж‘©е°”иҙЁйҮҸдёә41g CпјҺдёҠиҝ°еҸҚеә”дёӯпјҢжҜҸз”ҹжҲҗ1molAlNйңҖиҪ¬з§»3molз”өеӯҗ DпјҺдёҠиҝ°еҸҚеә”дёӯпјҢN2жҳҜиҝҳеҺҹеүӮпјҢAl2O3жҳҜж°§еҢ–еүӮ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
ж №жҚ®SO2йҖҡе…ҘдёҚеҗҢжә¶ж¶Ідёӯзҡ„е®һйӘҢзҺ°иұЎпјҢжүҖеҫ—з»“и®әжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
|
|||||||||||||||||||||
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘWгҖҒXгҖҒYгҖҒZдёәзҹӯе‘Ёжңҹе…ғзҙ пјҢеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§гҖӮWгҖҒZеҗҢдё»ж—ҸпјҢXгҖҒYгҖҒZеҗҢе‘ЁжңҹпјҢе…¶дёӯеҸӘжңүXдёәйҮ‘еұһе…ғзҙ гҖӮдёӢеҲ—иҜҙжі•дёҖе®ҡжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺеҺҹеӯҗеҚҠеҫ„пјҡX>Y>Z>W BпјҺWзҡ„еҗ«ж°§й…ёзҡ„й…ёжҖ§жҜ”Zзҡ„еҗ«ж°§й…ёзҡ„й…ёжҖ§ејә C. Wзҡ„ж°”жҖҒж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§е°ҸдәҺYзҡ„ж°”жҖҒж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§ DпјҺиӢҘWдёҺXеҺҹеӯҗеәҸж•°е·®дёә5пјҢеҲҷеҪўжҲҗеҢ–еҗҲзү©зҡ„еҢ–еӯҰејҸдёәX3W2
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸпјҢжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺз”Ізғ·зҡ„зҮғзғ§зғӯО”HпјқпјҚ890.3 kJВ·molпјҚ1пјҢеҲҷз”Ізғ·зҮғзғ§зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸеҸҜиЎЁзӨәдёә CH4(g)пјӢ2O2(g)===CO2(g)пјӢ2H2O(g)гҖҖО”HпјқпјҚ890.3 kJВ·molпјҚ1 BпјҺеңЁ101 kPaж—¶пјҢ2 g H2е®Ңе…ЁзҮғзғ§з”ҹжҲҗж¶ІжҖҒж°ҙпјҢж”ҫеҮә285.8 kJзғӯйҮҸпјҢж°ўж°”зҮғзғ§зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸиЎЁзӨәдёә2H2(g)пјӢO2 (g)===2H2O(l)гҖҖО”HпјқпјҚ571.6 kJВ·molпјҚ1 CпјҺHClе’ҢNaOHеҸҚеә”зҡ„дёӯе’ҢзғӯО”HпјқпјҚ57.3 kJВ·molпјҚ1пјҢеҲҷH2SO4е’ҢCa(OH)2еҸҚеә”зҡ„дёӯе’ҢзғӯО”Hпјқ2Г—(пјҚ57.3)kJВ·molпјҚ1 DпјҺ500 в„ғгҖҒ30 MPaдёӢпјҢе°Ҷ0.5 mol N2(g)е’Ң1.5 mol H2(g)зҪ®дәҺеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”з”ҹжҲҗNH3(g)пјҢж”ҫзғӯ19.3 kJпјҢе…¶зғӯеҢ–еӯҰж–№зЁӢејҸдёәN2(g)пјӢ3H2(g)
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ(гҖҖ гҖҖ) AпјҺNaClOжә¶ж¶Іе’ҢFeCl2жә¶ж¶Іж··еҗҲпјҡ2ClOпјҚпјӢFe2пјӢпјӢ2H2O===Fe(OH)2вҶ“пјӢ2HClO BпјҺNaHCO3жә¶ж¶ІдёӯеҠ и¶ійҮҸBa(OH)2жә¶ж¶ІпјҡHCO3пјҚ+Ba2++OHпјҚ-===BaCO3вҶ“+H2O CпјҺеңЁејәзўұжә¶ж¶ІдёӯNaClOдёҺFe(OH)3еҸҚеә”з”ҹжҲҗNa2FeO4пјҡ3ClOпјҚпјӢ2Fe(OH)3===2FeO DпјҺз”Ёй“ңдҪңз”өжһҒз”өи§ЈCuSO4жә¶ж¶Іпјҡ2Cu2пјӢпјӢ2H2O
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
вҖңдәәж–ҮеҘҘиҝҗгҖҒ科жҠҖеҘҘиҝҗгҖҒз»ҝиүІеҘҘиҝҗвҖқжҳҜеҢ—дә¬еҘҘиҝҗдјҡзҡ„йҮҚиҰҒзү№еҫҒпјҢе…¶дёӯзҰҒжӯўиҝҗеҠЁе‘ҳдҪҝз”Ёе…ҙеҘӢеүӮжҳҜйҮҚиҰҒдёҫжҺӘд№ӢдёҖгҖӮд»ҘдёӢдёӨз§Қе…ҙеҘӢеүӮзҡ„з»“жһ„еҲҶеҲ«дёәпјҡ
еҲҷе…ідәҺе®ғ们зҡ„иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺеҲ©е°ҝй…ёеҲҶеӯҗдёӯжңүдёүз§Қеҗ«ж°§е®ҳиғҪеӣўпјҢеңЁж ёзЈҒе…ұжҢҜж°ўи°ұдёҠе…ұжңүе…ӯдёӘеі° BпјҺ1 molе…ҙеҘӢеүӮXдёҺи¶ійҮҸжө“жәҙж°ҙеҸҚеә”пјҢжңҖеӨҡж¶ҲиҖ—4 mol Br2 CпјҺдёӨз§Қе…ҙеҘӢеүӮжңҖеӨҡйғҪиғҪе’Ңеҗ«3molNaOHзҡ„жә¶ж¶ІеҸҚеә” DпјҺдёӨз§ҚеҲҶеӯҗдёӯзҡ„жүҖжңүзўіеҺҹеӯҗеқҮдёҚеҸҜиғҪе…ұе№ійқў
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
е…Ёй’’ж¶ІжөҒеӮЁиғҪз”өжұ еҲ©з”ЁдёҚеҗҢд»·жҖҒзҰ»еӯҗеҜ№зҡ„ж°§еҢ–иҝҳеҺҹеҸҚеә”жқҘе®һзҺ°еҢ–еӯҰиғҪе’Ңз”өиғҪзҡ„зӣёдә’иҪ¬еҢ–пјҢе……з”өж—¶пјҢжғ°жҖ§з”өжһҒMгҖҒNеҲҶеҲ«иҝһжҺҘз”өжәҗзҡ„жӯЈжһҒе’ҢиҙҹжһҒгҖӮз”өжұ е·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ пјҲВ В В пјү AпјҺе……з”өиҝҮзЁӢдёӯпјҢNз”өжһҒйҷ„иҝ‘й…ёжҖ§еҮҸејұ BпјҺе……з”өиҝҮзЁӢдёӯпјҢNз”өжһҒдёҠV3+иў«иҝҳеҺҹдёәV2+ CпјҺж”ҫз”өиҝҮзЁӢдёӯпјҢH+з”ұNз”өжһҒеҗ‘Mз”өжһҒ移еҠЁ DпјҺж”ҫз”өиҝҮзЁӢдёӯпјҢMз”өжһҒеҸҚеә”дёәVO2++ 2H++e-= VO2+ +H2O
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||
|
дёӢиЎЁжҳҜ25в„ғж—¶жҹҗдәӣзӣҗзҡ„жә¶еәҰз§Ҝеёёж•°е’Ңејұй…ёзҡ„з”өзҰ»е№іиЎЎеёёж•°пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
AпјҺеёёжё©дёӢпјҢзӣёеҗҢжө“еәҰв‘ CH3COONH4 в‘ЎNH4HCO3 в‘ўпјҲNH4пјү2CO3жә¶ж¶ІдёӯпјҢcпјҲNH4+пјүз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜпјҡв‘ пјһв‘Ўпјһв‘ў BпјҺAgCl жҳ“жә¶дәҺж°Ёж°ҙйҡҫжә¶дәҺж°ҙпјҢжүҖд»ҘAgCl еңЁж°Ёж°ҙдёӯзҡ„Ksp еӨ§дәҺж°ҙдёӯзҡ„Ksp CпјҺеҗ‘йҘұе’Ңж°Ҝж°ҙдёӯж»ҙеҠ NaOH жә¶ж¶ІиҮіжә¶ж¶ІеҲҡеҘҪдёәдёӯжҖ§ж—¶пјҢcпјҲNa+пјү=2cпјҲClO-пјү+cпјҲHClOпјү DпјҺеҗ‘жө“еәҰеқҮдёә1Г—10-3molвҖўL-1зҡ„KCl е’ҢK2CrO4ж··еҗҲж¶Ідёӯж»ҙеҠ 1Г—10-3molвҖўL-1 зҡ„AgNO3жә¶ж¶ІпјҢCrO42-е…ҲеҪўжҲҗжІүж·Җ
|
|||||||||||
| 14. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||||||||
|
дёҖе®ҡжё©еәҰдёӢпјҢеңЁ3дёӘдҪ“з§ҜеқҮдёә1.0Lзҡ„жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҸҚеә”пјҡ2H2(g)+CO(g)
AпјҺиҜҘеҸҚеә”зҡ„жӯЈеҸҚеә”дёәеҗёзғӯеҸҚеә” BпјҺиҫҫеҲ°е№іиЎЎж—¶пјҢе®№еҷЁв… дёӯеҸҚеә”зү©иҪ¬еҢ–зҺҮжҜ”е®№еҷЁв…Ўдёӯзҡ„еӨ§ CпјҺиҫҫеҲ°е№іиЎЎж—¶пјҢе®№еҷЁв…Ўдёӯc(H2)еӨ§дәҺе®№еҷЁв…ўдёӯc(H2)зҡ„дёӨеҖҚ DпјҺиҫҫеҲ°е№іиЎЎж—¶пјҢе®№еҷЁв…ўдёӯзҡ„жӯЈеҸҚеә”йҖҹзҺҮжҜ”е®№еҷЁв… дёӯзҡ„еӨ§
|
||||||||||||||||||||||||||||||||
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–е·Ҙз”ҹдә§дёӯеёёеёёз”ЁеҲ°вҖңдёүй…ёдёӨзўұвҖқпјҢвҖңдёүй…ёвҖқжҢҮзЎқй…ёгҖҒзЎ«й…ёе’Ңзӣҗй…ёпјҢвҖңдёӨзўұвҖқжҢҮзғ§зўұе’ҢзәҜзўұгҖӮ В (1)д»Һзү©иҙЁзҡ„еҲҶзұ»и§’еәҰзңӢпјҢеҗҚдёҚз¬Ұе®һзҡ„дёҖз§Қзү©иҙЁжҳҜ__________________________гҖӮ (2)вҖңдёүй…ёвҖқдёҺвҖңдёӨзўұвҖқд№Ӣй—ҙеқҮеҸҜеҸҚеә”пјҢиӢҘз”ЁеҢ–еӯҰж–№зЁӢејҸиЎЁзӨәжңүе…ӯдёӘ(й…ёиҝҮйҮҸж—¶)пјҢиӢҘз”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәеҚҙеҸӘжңүдёӨдёӘпјҢиҜ·еҶҷеҮәиҝҷдёӨдёӘзҰ»еӯҗж–№зЁӢејҸ(й…ёиҝҮйҮҸж—¶)пјҡ __________________________________пјӣ _______________________________гҖӮ (3)вҖңдёүй…ёвҖқеёёз”ЁдәҺжә¶и§ЈйҮ‘еұһе’ҢйҮ‘еұһж°§еҢ–зү©гҖӮдёӢеҲ—еқ—зҠ¶йҮ‘еұһеңЁеёёжё©ж—¶иғҪе…ЁйғЁжә¶дәҺи¶ійҮҸжө“зЎқй…ёзҡ„жҳҜ_____(еЎ«еәҸеҸ·)В В В В В В AпјҺAlВ В В В В В В В В В В В BпјҺCuВ В В В В В В В В В В В В В В CпјҺFeВ В В В В В В В В В В В В DпјҺ Ag (4)зғ§зўұгҖҒзәҜзўұжә¶ж¶ІеқҮеҸҜеҗёж”¶CO2пјҢеҪ“еҗ«0.4molNaOHзҡ„жә¶ж¶Іеҗёж”¶дёҖе®ҡйҮҸCO2еҗҺпјҢе°Ҷжә¶ж¶ІдҪҺжё©и’ёе№Іеҫ—еҲ°еӣәдҪ“зҡ„з»„жҲҗеҸҜиғҪжңүеӣӣз§Қжғ…еҶөпјҢеҲҶеҲ«жҳҜпјҡв‘ _______в‘ЎNa2CO3 в‘ў___________в‘ЈNaHCO3гҖӮе°Ҷеҫ—еҲ°зҡ„еӣәдҪ“йҮҚж–°жә¶и§ЈдәҺж°ҙпјҢеңЁжә¶ж¶ІдёӯеҠ иҝҮйҮҸзҡ„зӣҗй…ёпјҢдҪҝе…¶е……еҲҶеҸҚеә”еҗҺпјҢеҫ—еҲ°жә¶ж¶ІжүҖеҗ«жә¶иҙЁзҡ„иҙЁйҮҸдёә__________gгҖӮ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
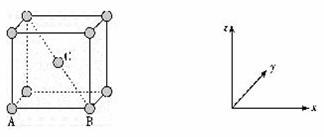
й’ҫзҡ„еҢ–еҗҲзү©е№ҝжіӣеӯҳеңЁдәҺиҮӘ然з•ҢдёӯгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲlпјүеӨ„дәҺдёҖе®ҡз©әй—ҙиҝҗеҠЁзҠ¶жҖҒзҡ„з”өеӯҗеңЁеҺҹеӯҗж ёеӨ–еҮәзҺ°зҡ„жҰӮзҺҮеҜҶеәҰеҲҶеёғеҸҜз”Ё_____еҪўиұЎеҢ–жҸҸиҝ°гҖӮ пјҲ2пјүй’ҫзҡ„з„°иүІеҸҚеә”дёә_____иүІпјҢеҸ‘з”ҹз„°иүІеҸҚеә”зҡ„еҺҹеӣ жҳҜ_____гҖӮ пјҲ3пјүеҸ ж°®еҢ–й’ҫпјҲKN3пјүжҷ¶дҪ“дёӯпјҢеҗ«жңүзҡ„е…ұд»·й”®зұ»еһӢжңү_____пјҢN3-зҡ„з©әй—ҙжһ„еһӢдёә_____гҖӮ пјҲ4пјүCOиғҪдёҺйҮ‘еұһKе’ҢMnеҪўжҲҗй…ҚеҗҲзү©K[Mn(CO)5]пјҢMnе…ғзҙ еҹәжҖҒеҺҹеӯҗзҡ„д»·з”өеӯҗжҺ’еёғејҸдёә_____гҖӮ пјҲ5пјүеҺҹеӯҗеқҗж ҮеҸӮж•°еҸҜиЎЁзӨәжҷ¶йҘұеҶ…йғЁеҗ„еҺҹеӯҗзҡ„зӣёеҜ№дҪҚзҪ®пјҢйҮ‘еұһй’ҫжҳҜдҪ“еҝғз«Ӣж–№жҷ¶зі»пјҢе…¶жһ„еһӢеҰӮеӣҫгҖӮе…¶дёӯеҺҹеӯҗеқҗж ҮеҸӮж•°AпјҲ0пјҢ0пјҢ0пјүгҖҒBпјҲlпјҢ0пјҢ0пјүпјҢеҲҷCеҺҹеӯҗзҡ„еқҗж ҮеҸӮж•°дёә_____гҖӮ
пјҲ6пјүй’ҫжҷ¶дҪ“зҡ„жҷ¶иғһеҸӮж•°дёәapmгҖӮеҒҮе®ҡйҮ‘еұһй’ҫеҺҹеӯҗдёәзӯүеҫ„зҡ„еҲҡжҖ§е°Ҹзҗғдё”еӨ„дәҺдҪ“еҜ№и§’зәҝдёҠзҡ„дёүдёӘзҗғзӣёеҲҮпјҢеҲҷй’ҫеҺҹеӯҗзҡ„еҚҠеҫ„дёә______pmпјҢжҷ¶дҪ“й’ҫзҡ„еҜҶеәҰи®Ўз®—ејҸжҳҜ_____g/cm3гҖӮ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
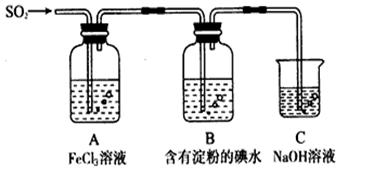
жҹҗе…ҙи¶Је°Ҹз»„жҺўз©¶SO2ж°”дҪ“иҝҳеҺҹFe3+гҖҒI2пјҢ他们дҪҝз”Ёзҡ„иҚҜе“Ғе’ҢиЈ…зҪ®еҰӮдёӢеӣҫжүҖзӨә
иҜ·жҢүиҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳ (1)дёӢеҲ—е®һйӘҢж–№жЎҲйҖӮз”ЁдәҺеңЁе®һйӘҢе®ӨеҲ¶еҸ–жүҖйңҖSO2зҡ„жҳҜ_______гҖӮ (2)иЈ…зҪ®Cзҡ„дҪңз”ЁжҳҜ____________гҖӮеҰӮжһңжңү560mL SO2ж°”дҪ“пјҲе·ІжҠҳз®—дёәж ҮжҖҒпјүиҝӣе…ҘCиЈ…зҪ® дёӯпјҢеҲҷCдёӯ50mL NaOHжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰиҮіе°‘дёәВ В В В В В В В В В В В mol/LжүҚиғҪиҫҫеҲ°зӣ®зҡ„гҖӮ (3)иӢҘиҰҒд»ҺAдёӯжүҖеҫ—жә¶ж¶ІжҸҗеҸ–жҷ¶дҪ“пјҢеҝ…йЎ»иҝӣиЎҢзҡ„е®һйӘҢж“ҚдҪңжӯҘйӘӨпјҡеҠ зғӯжө“зј©гҖҒеҶ·еҚҙз»“жҷ¶гҖҒ________гҖҒжҙ—ж¶ӨгҖҒиҮӘ然干зҮҘгҖӮеңЁиҝҷдёҖзі»еҲ—ж“ҚдҪңдёӯжІЎжңүз”ЁеҲ°зҡ„д»ӘеҷЁжңүпјҲеЎ«еәҸеҸ·пјү____гҖӮВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (5)жң¬е®һйӘҢдёӯиғҪиЎЁжҳҺSO2зҡ„иҝҳеҺҹжҖ§жҜ”I-зҡ„иҝҳеҺҹжҖ§ејәзҡ„зҺ°иұЎжҳҜ__________________пјҢе…¶еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә______________гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
дәҡзЎқй…ёй’ (NaNO2)жҳҜдёҖз§Қе·ҘдёҡзӣҗпјҢе®һйӘҢе®ӨеҸҜз”ЁеҰӮдёӢиЈ…зҪ®(з•ҘеҺ»йғЁеҲҶеӨ№жҢҒд»ӘеҷЁ)еҲ¶еӨҮгҖӮ
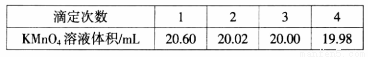
е·ІзҹҘпјҡв‘ 2NO+Na2O2=2NaNO2пјӣ в‘Ў3NaNO2+3HCl=3NaCl+HNO3+2NOвҶ‘+HВӯ2Oпјӣв‘ўй…ёжҖ§жқЎд»¶дёӢпјҢNOе’ҢNO2йғҪиғҪдёҺMnO4-еҸҚеә”з”ҹжҲҗNO3-е’ҢMn2+пјӣNa2O2иғҪдҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиӨӘиүІгҖӮ пјҲ1пјүеҠ зғӯиЈ…зҪ®AеүҚпјҢе…ҲйҖҡдёҖж®өж—¶й—ҙN2пјҢзӣ®зҡ„жҳҜ_______________гҖӮ пјҲ2пјүиЈ…зҪ®AдёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә__________________________________гҖӮе®һйӘҢз»“жқҹеҗҺпјҢе°ҶB瓶дёӯзҡ„жә¶ж¶Із»Ҹи’ёеҸ‘жө“зј©гҖҒ__________(еЎ«ж“ҚдҪңеҗҚз§°)гҖҒиҝҮж»ӨеҸҜиҺ·еҫ—CuSO4В·5H2OгҖӮ пјҲ3пјүд»ӘеҷЁCзҡ„еҗҚз§°дёә______________пјҢе…¶дёӯзӣӣж”ҫзҡ„иҚҜе“Ғдёә ____________(еЎ«еҗҚз§°)гҖӮ пјҲ4пјүе……еҲҶеҸҚеә”еҗҺпјҢжЈҖйӘҢиЈ…зҪ®Dдёӯдә§зү©зҡ„ж–№жі•жҳҜпјҡеҸ–дә§зү©е°‘и®ёзҪ®дәҺиҜ•з®ЎдёӯпјҢ________________пјҢеҲҷдә§зү©жҳҜNaNO2(жіЁжҳҺиҜ•еүӮгҖҒзҺ°иұЎ)гҖӮ пјҲ5пјүдёәжөӢе®ҡдәҡзЎқй…ёй’ зҡ„еҗ«йҮҸпјҢз§°еҸ–4.000gж ·е“Ғжә¶дәҺж°ҙй…ҚжҲҗ250mLжә¶ж¶ІпјҢеҸ–25.00mLжә¶ж¶ІдәҺй”ҘеҪўз“¶дёӯпјҢз”Ё0.1000molВ·L-1й…ёжҖ§KMnO4жә¶ж¶ІиҝӣиЎҢж»ҙе®ҡпјҢе®һйӘҢжүҖеҫ—ж•°жҚ®еҰӮдёӢиЎЁжүҖзӨәпјҡ
①第дёҖз»„е®һйӘҢж•°жҚ®еҮәзҺ°ејӮеёёпјҢйҖ жҲҗиҝҷз§ҚејӮеёёзҡ„еҺҹеӣ еҸҜиғҪжҳҜ_________(еЎ«д»ЈеҸ·)гҖӮ aпјҺй…ёејҸж»ҙе®ҡз®Ўз”Ёи’ёйҰҸж°ҙжҙ—еҮҖеҗҺжңӘз”Ёж ҮеҮҶж¶Іж¶Ұжҙ— bпјҺй”ҘеҪўз“¶жҙ—еҮҖеҗҺжңӘе№ІзҮҘ cпјҺж»ҙе®ҡз»ҲзӮ№ж—¶д»°и§ҶиҜ»ж•° в‘Ўж №жҚ®иЎЁдёӯж•°жҚ®пјҢи®Ўз®—жүҖеҫ—еӣәдҪ“дёӯдәҡзЎқй…ёй’ зҡ„иҙЁйҮҸеҲҶж•°__________гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
д»Ҙй“қеңҹзҹҝ(дё»иҰҒжҲҗеҲҶдёәAl2O3е’ҢжқӮиҙЁ)дёәеҺҹж–ҷеҲ¶еӨҮй“қзҡ„дёҖз§Қе·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ
жіЁпјҡеҸҚеә”в… вҖңзўұжә¶вҖқж—¶жқӮиҙЁиҪ¬еҢ–дёәжІүж·Җ пјҲ1пјүеҸҚеә”в… пјҢеҸ‘з”ҹеҸҚеә”з”ҹжҲҗеҒҸй“қй…ёй’ зҡ„зҰ»еӯҗж–№зЁӢејҸ__________гҖӮ пјҲ2пјүз”өи§Јв… жҳҜз”өи§ЈзҶ”иһҚзҡ„еҶ°жҷ¶зҹіе’ҢAl2O3зҡ„ж··еҗҲзү©пјҢз”өи§ЈиҝҮзЁӢдёӯдҪңйҳіжһҒзҡ„зҹіеўЁжҳ“ж¶ҲиҖ—пјҢеҺҹеӣ жҳҜ___________гҖӮ пјҲ3пјүеҸҚеә”в…ЎпјҢз”ЁдёҖе®ҡжө“еәҰзҡ„NaHCO3жә¶ж¶ІеӨ„зҗҶиҝҮж»Өв… еҗҺзҡ„ж»Өж¶ІпјҢжүҖеҫ—жә¶ж¶ІpHе’Ңз”ҹжҲҗAl(OH)3зҡ„йҮҸйҡҸеҠ е…ҘNaHCO3жә¶ж¶ІдҪ“з§ҜеҸҳеҢ–зҡ„жӣІзәҝеҰӮдёӢпјҡ
в‘ еҠ е…ҘNaHCO3жә¶ж¶ІдҪ“з§Ҝе°ҸдәҺ8 mLж—¶пјҢеҸ‘з”ҹдё»иҰҒеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ__________гҖӮ в‘ЎеҸҚеә”в…Ўдёӯз”ҹжҲҗAl(OH)3зҡ„зҰ»еӯҗж–№зЁӢејҸ__________гҖӮ пјҲ4пјүз”өи§Јв…ЎжҳҜз”өи§ЈNa2CO3жә¶ж¶ІпјҢеҫ—еҲ°еҗ«NaHCO3зҡ„йҳіжһҒж¶ІпјҢеҺҹзҗҶеҰӮдёӢеӣҫжүҖзӨәгҖӮ
йҳҙжһҒдә§з”ҹзҡ„зү©иҙЁAзҡ„еҢ–еӯҰејҸдёә____________гҖӮ пјҲ5пјүд»Ҙй“қжқҗдёәйҳіжһҒпјҢеңЁH2SO4жә¶ж¶Ідёӯз”өи§ЈпјҢеҸҜеңЁй“қжқҗиЎЁйқўеҪўжҲҗиҮҙеҜҶж°§еҢ–иҶңпјҢйҳіжһҒз”өжһҒеҸҚеә”ејҸдёә_______________гҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
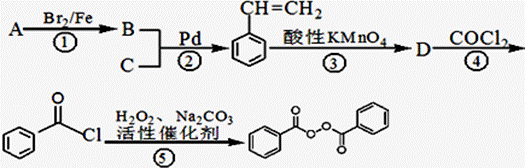
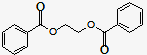
C14H10O4еёёз”Ёзҡ„жІ№и„ӮгҖҒиңЎзҡ„жјӮзҷҪеүӮгҖҒеҢ–еҰҶе“ҒеҠ©еүӮгҖҒж©Ўиғ¶зЎ«еҢ–еүӮгҖӮдёӢйқўжҳҜд»Ҙзү©иҙЁAдёәеҺҹж–ҷеҗҲжҲҗC14H10O4зҡ„жөҒзЁӢпјҡ зӨәдҫӢеҰӮдёӢпјҡ |
|
- 2018-2019е№ҙй«ҳдәҢ12жңҲжңҲиҖғеҢ–еӯҰдё“йўҳи®ӯз»ғпјҲжІіеҢ—зңҒиЎЎж°ҙеёӮжӯҰйӮ‘дёӯеӯҰпјү
- еҢ—дә¬й«ҳдёүеҢ–еӯҰжңҹжң«иҖғиҜ•пјҲ2018е№ҙеүҚеҚҠжңҹпјүеҗҢжӯҘз»ғд№
- еӨ©жҙҘеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·иҖғиҜ•е®Ңж•ҙзүҲ
- 2019е№ҙз§Ӣй«ҳдёүеҢ–еӯҰеӨҚд№ ејәеҢ–з»ғд№ --зҰ»еӯҗеҸҚеә”
- е…ЁеӣҪ2019е№ҙй«ҳдёүеҗҺеҚҠжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- й«ҳдёүеҢ–еӯҰдёҠеҶҢеҚ•е…ғжөӢиҜ•ж‘ёеә•иҖғиҜ•йўҳ
- дёҠжө·еёӮ2018е№ҙй«ҳдәҢеҢ–еӯҰеүҚеҚҠжңҹжңҹжң«иҖғиҜ•йҷ„зӯ”жЎҲдёҺи§Јжһҗ
- зҰҸе»ә2020е№ҙй«ҳдёүдёӢеҚҠе№ҙеҢ–еӯҰдё“йўҳз»ғд№ е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ