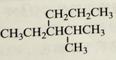2017高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列离子中半径最小的是 A.Mg2+ B.Na+ C.O2- D. F-
|
|
| 2. | 详细信息 |
|
下列关于化学用语的表示正确的是 A.过氧化钠的电子式: B.质子数为35、中子数为45的溴原子: C.乙烯的结构简式:CH2CH2 D.间二甲苯的结构简式:
|
|
| 3. | 详细信息 |
|
下列物质见光不会分解的是 A.HClO B.NaHCO3 C.HNO3 D.AgNO3
|
|
| 4. | 详细信息 |
|
不能作为判断硫、氯两种元素非金属性强弱的依据是 A.单质氧化性的强弱 B.单质与氢气化合的难易 C.单质沸点的高低 D.最高价氧化物对应的水化物酸性的强弱
|
|
| 5. | 详细信息 |
|
关于11~17号元素的性质比较中:①元素的最高 A.①② B.③④ C.全都不正确 D.①②③④
|
|
| 6. | 详细信息 |
|
重水(D2O)是重要的核工业原料,下列说法错误的是 A.氘(D)原子核外有1个电子 B.1H与D互称同位素 C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
|
|
| 7. | 详细信息 |
|
下列物质性质与应用对应关系正确的是 A.晶体硅熔点高硬度大,可用于制作半导 B.氢氧化铝具有弱碱性,可用于制胃酸中和剂 C.漂白粉在空气中不稳定,可用于漂白纸张 D.氧化铁能与酸反应,可用于制作红色涂料
|
|
| 8. | 详细信息 |
|
下列物质按只含共价键、只含离子键、既含离子键又含共价键的顺序排列的是 A.过氧化氢 氯化钠 氯化铵 B.氯化钠 过氧化钠 氯化铵 C.氯气 氢氧化钠 二氧化碳 D.氦气 氯化钠 氢氧化钠
|
|
| 9. | 详细信息 |
|
下列有关物质性质的比较,错误的是 A.碱性:LiOH<NaOH B.硬度:C60<金刚石 C.密度:苯>水 D.稳定性:HCl>H2S
|
|
| 10. | 详细信息 |
|
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子 数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法不正确的是 A.原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y) B.Y分别与Z、W形成的化合物中化学键类型相同 C.X的最高价氧化物对应水化物的酸性比W的强 D.Y的气态简单氢化物的热稳定性比W的强
|
|
| 11. | 详细信息 |
|
.下列指定反应的离子方程式正确的是 A.钠与水反应: Na +2H2O B.电解饱和食盐水获取烧碱和氯气: 2Cl–+2H2O C.向氢氧化钡溶液中加入稀硫酸: Ba2++OH– + H+ + D.向碳酸氢钙溶液中加入足量氢氧化钠溶液: Ca2++
|
|
| 12. | 详细信息 |
|
下列各组物质的熔点均与化学键无关的是 A.CaO与CO2 B.NaCl与HCl C.MgO与SiO2 D.Cl2与I2
|
|
| 13. | 详细信息 |
|
烷烃 A.4-甲基-3-丙基戊烷 B.3-异丙基己烷 C.2-甲基-3-丙基戊烷 D.2-甲基-3-乙基己烷
|
|
| 14. | 详细信息 |
|
下列说法中正确的一组 A.H2和D2互为同位素 B.CH3-CH2-OH与CH3-O-CH3互为同分异构体 C.正丁烷和异丁烷是同素异形体 D.
|
|
| 15. | 详细信息 |
|
2013年4月24日,某航空公司首 A.点燃,能燃烧的是矿物油 B.测定沸点,有固定沸点的是矿物油 C.加入水中,浮在水面上的是地沟油 D.加入足量氢氧化钠溶液共热,不分层的是地沟油
|
|
| 16. | 详细信息 |
|
下列关于有机物的说法正确的是 A.石油的裂化的目的主要是为了提高轻质油的产 B.棉花、羊毛、蚕丝均属于天然纤维素 C.所有的糖类、油脂和蛋白质均可发生水解反应 D.苯和乙烯都能使溴水褪色,其褪色原理是相同的
|
|
| 17. | 详细信息 |
|
下列鉴别方法不可行的是 A.用水鉴别乙醇、甲苯 B.用燃烧法鉴别乙醇、苯 C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 D.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
|
|
| 18. | 详细信息 |
|
下列关于有机化合物的说法正确的是 A.2-甲基丙烷的一氯代物只有一种 B.戊烷(C5H12)有两种同分异构体 C.乙醇可以转化成乙酸,乙醇和乙酸都能发生取代反应 D.乙烯、聚氯乙烯和苯分子均含有碳碳双键
|
|
| 19. | 详细信息 |
|
若有甲酸、乙酸、甲醇和乙醇在一定条件下于同一反应体系中发生酯化反应,则理论上能最多生成几种酯 A.2种 B.3种 C.4种 D.5种
|
|
| 20. | 详细信息 |
|
绿色化学是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应不符合绿色化学概念的 A.消除硫酸厂尾气排放:SO2+2NH3+H2O===(NH4)2SO3 B.消除制硝酸厂的氮氧化物污染:NO2+NO C.制CuSO4:Cu+2H2SO4(浓) D.制CuSO4:2Cu+O2
|
|
| 21. | 详细信息 | ||||||||||||||||||||
|
分析下表中各项的排布规律,按此规律排布C8H18在表中应为
A.第24项 B.第25项 C.第26项 D.第27项
|
|||||||||||||||||||||
| 22. | 详细信息 |
|
设NA为阿伏加德罗常数值。下列有关叙述正确的是 A.标准状况下,2.24LCCl4含有的共价键数为0.42NA B.氢原子数为0.4NA的甲醇分子中含有的键数为0.4NA C.1 D.14
|
|
| 23. | 详细信息 |
|
已知:SO32-+I2+H2O==SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-, A.肯定不含I- B.肯定不含SO42- C.肯定含有SO32- D.可能含有NH4+
|
|
| 24. | 详细信息 |
|
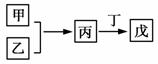
A.若甲既能与盐酸反应又能与NaOH溶液反应则丙可能属于两性氧化物 B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
|
|
| 25. | 详细信息 | ||||||||
|
下列实验装置正确且能达到实验目的的是
|
|||||||||
| 26. | 详细信息 |
|
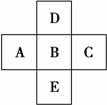
如图所示,已知A元素的最低化合价为-3价,D元素和B元素可形成2种化合物。试回答下列问题(均用具体的元素符号回答):
A______,B________,C__________,D_______; (2)A、B、C、D的气态氢化物稳定性最差的是_____; (3)A、B、C的原子半径由小到大 (4)A、B、C三元素最高价氧化物对应水化物的酸性由强到弱的顺序是: _____; (5)用化学方程式表示元素C的非金属性大于B元素;__________
|
|
| 27. | 详细信息 |
|
甲、乙、丙、丁分别是乙烷、乙烯、乙炔、苯中的一种; ①甲、乙能使溴的四氯化碳溶液褪色。乙与等物质的量的H2反应生成甲,甲与等物质的量的H2反应生成丙。 ②丙既不能使溴的四氯化碳溶液褪色,也不能使KMnO4酸性溶液褪色。 ③丁能使溴水褪色的原因与甲能使溴水褪色的原因不同,丁也不能使KMnO4酸性溶液褪色,但丁在一定条件下可与溴发生取代反应。相同条件下,丁蒸气的密度是乙密度的3倍。 据以上叙述完成下列问题: (1)写出甲的结构简式__________、乙的结构式____________、丙分子中含有的化学键类型是__________; (2)写出丁与液溴在催化剂作用下发生取代反应的方程式____________ ; (3)写出甲使溴的四氯化碳溶液褪色的化学方程式___________________ 。
|
|
| 28. | 详细信息 |
|
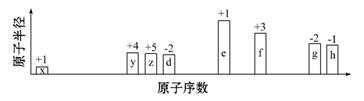
随原子序数递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。 根据判断出的元素回答问题: (1)f在周期表中的位置是 。 (2)比较d、e常见离子的半径大小(用化学式表示,下 (3)任选上述元素组成一种四原子共价化合物,写出其电子式: 。 (4)写出e的单质在足量d2中燃烧后的产物与y的高价氧化物反应的化学方程式: 。
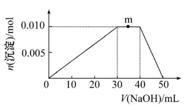
①化合物R中所含化学键的类型分别为:;盐R属于晶体。 ②写出m点反应的离子方程式: 。 ③若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol。
|
|
| 29. | 详细信息 |
|
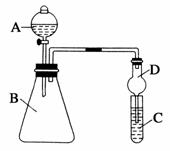
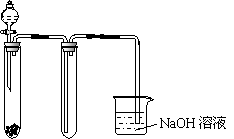
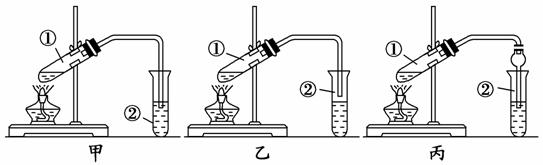
下面是甲、 【实验目的】制取乙酸乙酯 【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。 【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置: 请从甲、乙两位同学设计的装置中选择一种作为实验室制 【实验步骤】 (1)用酒精灯对试管①加热;(2)将试管①固定在铁架台上(3)按所选择的装置组装仪器,在试管①中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;(4)在试管②中加入适量的饱和Na2CO3溶液;(5)当观察到试管②中有明显现象时停止实验。 【问题讨论】 a.用序号写出该实验的步骤____________; b.装好实验装置,加入药品前还应检查____________; c.写出试管①发生反应的化学方程式(注明反应条件) _____________________; d.试管②中饱和Na2CO3溶液的作用是_____________________________。
|
|
| 30. | 详细信息 |
|
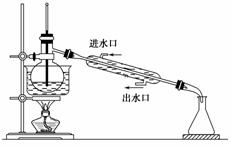
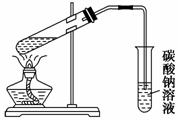
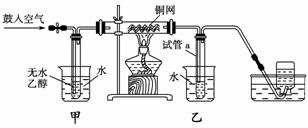
某实验小组用下列装置进行乙醇催化氧化的实验。 (1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式 、 ; (2)甲和乙两个水浴作用不相同。甲的作用是________________,乙的作用是________________; (3)反应进行一段时间后,试管a中能收集到不同的物质,它们是_______; 集气瓶中收集到的气体的主要成分是___________________________。 (4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有________________。要除去该物质,可先在混合液中加入________(填写字母),然后再通过蒸馏即可除去。 a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
|
|