2020安徽高二上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
在一定条件下,Na2S溶液存在水解平衡:S2−+H2O A. 稀释溶液,水解平衡常数增大 B. 升高温度,c(HS−)/c(S2−)增大 C. 加入NaOH固体,溶液pH减小 D. 通入CuSO4固体,HS−浓度增大
|
|
| 2. | 详细信息 |
|
下列有关叙述中正确的是 ( ) A. 碳酸钙在水里的溶解度很小,所以碳酸钙是弱电解质 B. NH3的水溶液能导电,所以NH3是电解质 C. 强电解质在水溶液中的电离过程是不可逆的 D. 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强
|
|
| 3. | 详细信息 |
|
常温下,Ka(HCOOH) =1.77×10—4,Ka(CH3COOH) =1.75×10—5,下列说法正确的是( ) A. pH均为3的HCOOH和盐酸等体积混合后,pH变小 B. 0.2 mol•L—1 CH3COONa 与 0.1 mol•L﹣1盐酸等体积混合后的溶液中(pH<7):c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+) C. 0.2 mol•L—1 HCOOH 与 0.1 mol•L—1 NaOH 等体积混合后的溶液中:c(HCOO—) +c(HCOOH) =0.2 mol•L—1 D. 中和浓度和体积均相同的HCOOH和CH3COOH,所用NaOH的物质的量不同
|
|
| 4. | 详细信息 |
|
下列有关说法正确的是( ) A.25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol,则甲烷的燃烧热为Q kJ/mol B.CaCO3(s)=CaO(s)+CO2 (g) 室温下不能自发进行,说明该反应的 ΔH<0 C.反应N2(g)+3H2(g) D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):H2(g) +Cl2(g)=2HCl(g),△H1=—Q1 kJ/mol,H2(g) +Br2(g)=2HBr(g),△H2=—Q2 kJ/mol,则△H1<△H2
|
|
| 5. | 详细信息 |
|
在一定条件下,CO和CH4燃烧的热化学方程式分别为:2CO(g) + O2(g) = 2CO2(g);△H =-566kJ/mol;CH4(g) + 2O2(g) = CO2(g) + 2H2O(l);△H =-890kJ/mol由1molCO和3molCH4组成的混和气在上述条件下完全燃烧时,释放的热量为( )。 A. 2912kJ B. 2953kJ C. 3236kJ D. 3867kJ
|
|
| 6. | 详细信息 |
|
已知热化学方程式:2H2(g)+O2(g) A. CH3OH的燃烧热为1452 kJ·mol-1 B. 2H2(g)+O2(g) C. CH3COOH(aq)+NaOH(aq) D. 2CH3OH(l)+O2(g)
|
|
| 7. | 详细信息 |
|
下列说法或表示法正确的是( ) A. 等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B.由C(石墨)→C(金刚石)ΔH = +1.9 kJ·mol-1可知,金刚石比石墨稳定 C. 在稀溶液中:H+ + OH﹣ = H2O ΔH = ﹣57.3 kJ·mol-1,若将含1 mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)= 2H2O(l)ΔH = +285.8 kJ·mol-1
|
|
| 8. | 详细信息 |
|
下列化学用语的相关表述中正确的是( ) A. 因H+(aq) +OH- (aq)==H2O(l) △H=-akJ·mol-1,故1molNaOH 固体与足量的稀盐酸反应,放出的热量为akJ B. 因CuSO4·5H2O(s)==CuSO4(s)+5H2O(1) △H= +b kJ·mol-1,故1mol CuSO4(s)溶于水时,放出的热量为bkJ C. 因氢气的燃烧热为c kJ·mol-1,故水电解的热化学方程式为2H2O (l)==2H2(g)+O2(g) △H=+c kJ·mol-1 D. 因N2(g)+ 3H2(g)
|
|
| 9. | 详细信息 |
|
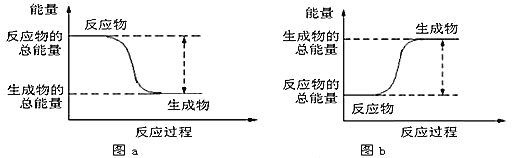
如图所示,有关化学反应和能量变化的说法不正确的是( ) A. 图a表示的是放热反应的能量变化 B. 图b表示反应物的键能总和高于生成物的键能总和 C. 图b 可以表示氯化铵固体与氢氧化钡晶体反应的能量变化 D. 图a不需要加热就一定能发生,图b一定需要加热才能发生
|
|
| 10. | 详细信息 |
|
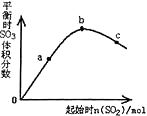
在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)
|
|
| 11. | 详细信息 |
|
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)
A. 30~40 min间该反应使用了催化剂 B. 反应方程式中的x=1,正反应为吸热反应 C. 8 min前A的平均反应速率为0.08 mol·L-1·min-1 D. 30 min时降低温度, 40 min时升高温度
|
|
| 12. | 详细信息 |
|
下图是198 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
A.该反应的热化学方程式为:N2 + 3H2 B.向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 C.b曲线可能是加入催化剂时的能量变化曲线 D.加入正催化剂可增大正反应速率,降低逆反应速率
|
|
| 13. | 详细信息 |
|
密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
|
|
| 14. | 详细信息 |
|
在体积固定的2L的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2 A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 B. 降低温度,正反应速率减小程度比逆反应速率减小程度大 C. 将生成物SO3通入过量BaCl2溶液中,得到沉淀的质量为233g D. 达到平衡时,平衡常数为2.5
|
|
| 15. | 详细信息 | ||||||||||||||
|
一定温度下,10ml 0.40mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
下列叙述不正确的是(溶液体积变化忽略不计)( ) A. 0~6min的平均反应速率: v(H2O2)≈3.3×10-2 mol/(L·min) B. 6~10min的平均反应速率: v(H2O2)<3.3×10-2 mol/(L·min) C. 反应至6min时, c(H2O2)=0.30mol·L-1 D. 反应至6min时,H2O2分解了50%
|
|||||||||||||||
| 16. | 详细信息 |
|
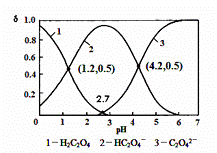
已知草酸为二元弱酸:H2C2O4
|
|
| 17. | 详细信息 |
|
Ⅰ. (1)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”); (2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为 ; (3) 将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则盐酸的体积 氨水的体积(填“>”“=”或“<”); (4)等体积的NH4HSO4溶液与NaOH溶液混合呈中性,则原C(NH4HSO4 ) 原C(NaOH) (填“>”“=”或“<”),混合后溶液中C(SO42-) C(NH4+) (填“>”“=”或“<”)。 Ⅱ.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作: A.在250mL容量瓶中定容成250 B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞指示剂 C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解 D.将物质的量浓度为M mol·L-1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数为 E.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积 回答下列问题: (1)正确的操作步骤的顺序是(用字母填写) → → →D→ (2)使用滴定管之前应进行的操作是 , (3)操作E中的锥形瓶下垫一张白纸的作用是 (4) 若酸式滴定管未用盐酸标准溶液润洗,会对测定结果有何影响 (填“偏高”、“偏低”或“无影响”)。 (5)该烧碱样品的纯度计算式是
|
|
| 18. | 详细信息 |
|
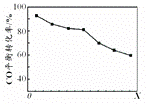
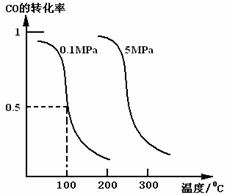
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。 (1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)
①该反应的逆反应属于________反应;(填“吸热”或“放热”)。 ②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点) ③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。 (2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知: ①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1 ②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1 则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。 (3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
|
|
| 19. | 详细信息 | |||||||||||||||||||||||||
|
工业上利用CO和水蒸气在一定条件下发生反应制取氢气: CO(g)+H2O(g) 某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量_____________(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。 (2)容器①中反应达平衡时,CO的转化率为_____________。 (3)计算容器①中反应的平衡常数K=_____________。某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正 V逆(填大于,小于或等于) (4)下列叙述正确的是_____________(填字母序号)。 a.平衡时,两容器中H2的体积分数相等 b.容器②中反应达平衡状态时,Q > 65.6 kJ c.反应开始时,两容器中反应的化学反应速率相等 d.平衡时,两容器中CO的转化率相同 (5)已知:2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式: 。
|
||||||||||||||||||||||||||