2017е№ҝдёңй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺй“Ғзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү в‘ й“ҒиғҪиў«зЈҒй“Ғеҗёеј•пјҢдҪҶзәҜй“Ғжҳ“и…җиҡҖ в‘ЎеңЁдәәдҪ“зҡ„иЎҖзәўиӣӢзҷҪдёӯеҗ«жңүй“Ғе…ғзҙ в‘ўй“ҒдҪҚдәҺе…ғзҙ е‘ЁжңҹиЎЁдёӯ第еӣӣе‘Ёжңҹ第ⅧBж—Ҹ в‘Јй“ҒиғҪеңЁж°§ж°”дёӯеү§зғҲзҮғзғ§пјҢдҪҶдёҚиғҪеңЁж°ҙи’ёж°”дёӯзҮғзғ§ в‘Өй“ҒдёҺејәж°§еҢ–еүӮзЎқй…ёеҸҚеә”зҡ„дә§зү©д»…жҳҜFeпјҲNO3пјү3 в‘ҘдёҚиғҪйҖҡиҝҮеҢ–еҗҲеҸҚеә”еҲ¶еҫ—FeCl2е’ҢFeпјҲOHпјү3пјҺ AпјҺв‘ в‘ў BпјҺв‘Ўв‘Ј CпјҺв‘Ўв‘Ө DпјҺв‘Јв‘Ҙ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
зҺ°жңүжҳ“жә¶ејәз”өи§ЈиҙЁзҡ„ж··еҗҲжә¶ж¶І10LпјҢе…¶дёӯеҸҜиғҪеҗ«еӯҳK+гҖҒBa2+гҖҒNa+гҖҒNH4+гҖҒClп№ЈгҖҒSO42п№ЈгҖҒAlO2п№ЈгҖҒOHп№Јдёӯзҡ„еҮ з§ҚпјҢеҗ‘е…¶дёӯйҖҡе…ҘCO2ж°”дҪ“пјҢдә§з”ҹжІүж·Җзҡ„йҮҸдёҺйҖҡе…ҘCO2зҡ„йҮҸд№Ӣй—ҙзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
AпјҺиҜҘжә¶ж¶ІдёӯиғҪзЎ®е®ҡеӯҳеңЁзҡ„зҰ»еӯҗжҳҜ Ba2+гҖҒAlO2п№ЈгҖҒNH4+ BпјҺиӮҜе®ҡдёҚеӯҳеңЁзҡ„зҰ»еӯҗжҳҜSO42п№ЈгҖҒOHп№Ј CпјҺиӢҘдёҚиғҪзЎ®е®ҡзҡ„зҰ»еӯҗдёӯиҮіе°‘иҝҳеӯҳеңЁдёҖз§ҚйҳізҰ»еӯҗпјҢеҲҷиҜҘзҰ»еӯҗзҡ„жңҖе°Ҹжө“еәҰдёә0.2mol/L DпјҺOA ж®өеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ2 AlO2п№Ј+CO2+3H2O=2AlпјҲOHпјү3вҶ“+CO32п№Ј
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺеҗ‘еҗ«жңүCaCO3жІүж·Җзҡ„ж°ҙдёӯйҖҡе…ҘCO2иҮіжІүж·ҖжҒ°еҘҪжә¶и§ЈпјҢеҶҚеҗ‘жә¶ж¶ІдёӯеҠ е…ҘNaHCO3йҘұе’Ңжә¶ж¶ІпјҢеҸҲжңүCaCO3жІүж·Җз”ҹжҲҗ BпјҺеҗ‘Na2CO3жә¶ж¶ІдёӯйҖҗж»ҙеҠ е…Ҙзӯүзү©иҙЁзҡ„йҮҸзҡ„зЁҖзӣҗй…ёпјҢз”ҹжҲҗзҡ„CO2дёҺеҺҹNa2CO3зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1пјҡ2 CпјҺзӯүиҙЁйҮҸзҡ„NaHCO3е’ҢNa2CO3еҲҶеҲ«дёҺи¶ійҮҸзӣҗй…ёеҸҚеә”пјҢеңЁеҗҢжё©еҗҢеҺӢдёӢпјҢз”ҹжҲҗзҡ„CO2дҪ“з§ҜзӣёеҗҢ DпјҺеҗ‘Na2CO3йҘұе’Ңжә¶ж¶ІдёӯйҖҡе…ҘCO2пјҢжңүNaHCO3з»“жҷ¶жһҗеҮә
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺ1 L 0.1 mol/Lзҡ„NaHCO3жә¶ж¶ІдёӯпјҢHCO3п№ЈгҖҒCO32п№ЈзҰ»еӯҗж•°д№Ӣе’Ңдёә0.1NA BпјҺ44 g CO2гҖҒN2Oз»„жҲҗзҡ„ж··еҗҲж°”дҪ“дёӯжүҖеҗ«жңүзҡ„еҺҹеӯҗж•°дёә3 NA CпјҺ36g3H2дёӯеҗ«жңүзҡ„дёӯеӯҗж•°зӣ®дёә24 NA DпјҺ2.24 LпјҲж ҮеҮҶзҠ¶еҶөпјүO2дёҺй’ еҸҚеә”ж—¶пјҢиҪ¬з§»з”өеӯҗж•°зӣ®еҸҜиғҪдёә0.3 NA
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
жҹҗеӯҰз”ҹз”Ё Na2CO3е’Ң KHCO3 з»„жҲҗзҡ„жҹҗж··еҗҲзү©иҝӣиЎҢе®һйӘҢпјҢжөӢеҫ—еҰӮиЎЁж•°жҚ®пјҲзӣҗй…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰзӣёзӯүдё”дёҚиҖғиҷ‘HClзҡ„жҢҘеҸ‘пјүдёӢеҲ—жңүе…ізҡ„иҜҙжі•дёӯпјҢжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
AпјҺзӣҗй…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә 2 molвҖўLп№Ј1 BпјҺеҺҹж··еҗҲзү©ж ·е“Ғдёӯ nпјҲNa2CO3пјүпјҡnпјҲKHCO3пјү=1пјҡ1 CпјҺе®һйӘҢв‘ЎдёӯпјҢж··еҗҲзү©иҝҮйҮҸ DпјҺе®һйӘҢв‘ЈеҸҚеә”еҗҺпјҢиҮіе°‘йңҖ继з»ӯеҠ е…Ҙ 40ml зҡ„иҜҘзӣҗй…ёжә¶ж¶ІжүҚиғҪжҠҠ12.24g зҡ„ж··еҗҲзү©е…ЁйғЁеҸҚеә”
|
|||||||||||||||||||||
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ23е…ӢйҮ‘еұһй’ ж”ҫе…Ҙи¶ійҮҸmgж°ҙдёӯпјҢеҶҚе°Ҷ24е…ӢйҮ‘еұһй•Ғж”ҫе…Ҙи¶ійҮҸmе…ӢзЁҖзӣҗй…ёдёӯпјҺеҸҚеә”еҗҺжүҖеҫ—жә¶ж¶Ізҡ„иҙЁйҮҸеҲҶеҲ«дёәaе…Ӣе’Ңbе…ӢпјҺйӮЈд№ҲпјҢaе’ҢbдёӨж•°еҖјзҡ„е…ізі»еә”жҳҜпјҲгҖҖгҖҖпјү AпјҺaпјһb BпјҺaпјңb CпјҺa=bВ DпјҺж— жі•зЎ®е®ҡ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зү©иҙЁдә’зӣёдҪңз”Ёж—¶пјҢз”ҹжҲҗзү©дёҚйҡҸеҸҚеә”жқЎд»¶жҲ–еҸҚеә”зү©зҡ„йҮҸеҸҳеҢ–иҖҢеҸҳеҢ–зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺNaHCO3жә¶ж¶Іе’ҢNaOHжә¶ж¶І BпјҺNaOHжә¶ж¶Іе’ҢCO2 CпјҺNaе’ҢO2В В DпјҺNa2CO3жә¶ж¶Іе’Ңзӣҗй…ё
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
з„°зҒ«иЎЁжј”пјҢзІҫеҪ©зә·е‘ҲпјҢжңүзқҖжө“еҺҡзҡ„ең°ж–№зү№иүІпјҢи®©дәәжғҠеҸ№дёҚе·ІпјҺдёӢеҲ—е…ідәҺз„°иүІеҸҚеә”зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺжҜҸж¬Ўз„°иүІеҸҚеә”е®һйӘҢеүҚпјҢй“ӮдёқиҰҒе…Ҳз”ЁзЎ«й…ёжҙ—ж¶Ө BпјҺз”ЁеӣәдҪ“ж ·е“ҒжҲ–й…ҚжҲҗзӣёеә”зҡ„жә¶ж¶ІиҝӣиЎҢз„°иүІеҸҚеә”пјҢзҺ°иұЎзӣёеҗҢ CпјҺз„°иүІеҸҚеә”еқҮеә”йҖҸиҝҮи“қиүІй’ҙзҺ»з’ғи§ӮеҜҹ DпјҺйқһйҮ‘еұһеҚ•иҙЁзҮғзғ§ж—¶зҒ«з„°еқҮдёәж— иүІ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еҒҡеҢ–еӯҰе®һйӘҢж—¶пјҢеҝ…йЎ»еҚҒеҲҶйҮҚи§Ҷе®үе…Ёе’ҢзҺҜдҝқй—®йўҳпјҺдёӢеҲ—ж“ҚдҪңж–№жі•дёҚз¬ҰеҗҲдёҠиҝ°иҰҒжұӮзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺй’ гҖҒй•ҒзӯүйҮ‘еұһзқҖзҒ«пјҢдёҚеҸҜз”ЁCO2зҒӯзҒ« BпјҺеңЁж°”дҪ“еҸ‘з”ҹиЈ…зҪ®дёҠзӮ№зҮғж°ўж°”зӯүж°”дҪ“ж—¶пјҢеҝ…йЎ»е…ҲжЈҖйӘҢж°”дҪ“зҡ„зәҜеәҰ CпјҺе®һйӘҢз»“жқҹеҗҺе°ҶжүҖжңүзҡ„еәҹж¶ІеҖ’е…ҘдёӢж°ҙйҒ“жҺ’еҮәе®һйӘҢе®ӨпјҢд»Ҙе…ҚжұЎжҹ“е®һйӘҢе®Ө DпјҺз»ҷиҜ•з®Ўдёӯзҡ„ж¶ІдҪ“еҠ зғӯж—¶пјҢдёҚеҒңжІҝиҜ•з®ЎеҖҫж–ңж–№еҗ‘移еҠЁиҜ•з®ЎжҲ–еҠ е…ҘзўҺз“·зүҮпјҢд»Ҙе…Қж¶ІдҪ“жҡҙжІёдјӨдәә
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗе®һйӘҢе°Ҹз»„еҜ№дёҖеҗ«жңүAl3+зҡ„жңӘзҹҘжә¶ж¶ІиҝӣиЎҢдәҶеҰӮдёӢеҲҶжһҗпјҡ пјҲ1пјүж»ҙе…Ҙе°‘йҮҸж°ўж°§еҢ–й’ пјҢж— жҳҺжҳҫеҸҳеҢ–пјӣ пјҲ2пјү继з»ӯж»ҙеҠ NaOHжә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җпјӣ пјҲ3пјүж»ҙе…ҘиҝҮйҮҸзҡ„ж°ўж°§еҢ–й’ пјҢзҷҪиүІжІүж·ҖжҳҺжҳҫеҮҸе°‘пјҺе®һйӘҢе°Ҹз»„з»Ҹе®ҡйҮҸеҲҶжһҗпјҢеҫ—еҮәеҰӮеӣҫжүҖзӨәжІүж·ҖдёҺж»ҙе…Ҙж°ўж°§еҢ–й’ дҪ“з§Ҝзҡ„е…ізі»пјҺдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲгҖҖгҖҖпјү
AпјҺиҜҘжңӘзҹҘжә¶ж¶ІдёӯиҮіе°‘еҗ«жңү3з§ҚйҳізҰ»еӯҗ BпјҺж»ҙеҠ зҡ„NaOHжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә5 molвҖўLп№Ј1 CпјҺиӢҘеҸҰдёҖз§ҚзҰ»еӯҗдёәдәҢд»·йҳізҰ»еӯҗпјҢеҲҷa=10 DпјҺиӢҘе°ҶжңҖз»ҲжІүж·ҖиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒзҒјзғ§пјҢе…¶иҙЁйҮҸдёҖе®ҡдёә6 g
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺ0.1mol/LNa2CO3жә¶ж¶Ізҡ„еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺ0.5LиҜҘжә¶ж¶Ідёӯй’ зҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә0.1mol/L BпјҺ1LиҜҘжә¶ж¶Ідёӯеҗ«жңүNa2CO3зҡ„иҙЁйҮҸдёә10.6g CпјҺд»Һ1LиҜҘжә¶ж¶ІдёӯеҸ–еҮә100mLпјҢеҲҷеҸ–еҮәжә¶ж¶ІдёӯNa2CO3зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә0.01mol/L DпјҺеҸ–иҜҘжә¶ж¶І10mLпјҢж»ҙеҠ зЁҖзЎ«й…ёпјҢејҖе§Ӣж— зҺ°иұЎ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘59.2g Fe2O3е’ҢFeOзҡ„ж··еҗҲзү©дёӯеҠ е…Ҙжҹҗжө“еәҰзҡ„зЁҖзЎқй…ё1.0LпјҢеӣәдҪ“зү©иҙЁе®Ңе…ЁеҸҚеә”пјҢз”ҹжҲҗNOе’ҢFeпјҲNO3пјү3пјҺеңЁжүҖеҫ—жә¶ж¶ІдёӯеҠ е…Ҙ1.0mol/Lзҡ„NaOHжә¶ж¶І2.8LпјҢжӯӨж—¶жә¶ж¶Іе‘ҲдёӯжҖ§пјҢйҮ‘еұһзҰ»еӯҗе·Іе®Ңе…ЁжІүж·ҖпјҢжІүж·ҖиҙЁйҮҸдёә85.6gпјҺдёӢеҲ—жңүе…іиҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺFe2O3дёҺFeOзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1пјҡ6 BпјҺзЎқй…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә3.0 mol/L CпјҺдә§з”ҹзҡ„NOеңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„дҪ“з§Ҝдёә4.48 L DпјҺFe2O3пјҢFeOдёҺзЎқй…ёеҸҚеә”еҗҺеү©дҪҷHNO3дёә0.2 mol
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺж°ўж°ҹй…ёгҖҒжө“зЎқй…ёгҖҒзЎ…й…ёй’ жә¶ж¶Ідҫқж¬ЎдҝқеӯҳеңЁжЈ•иүІзҺ»з’ғ瓶гҖҒж— иүІз»ҶеҸЈз“¶гҖҒеёҰиғ¶еЎһз»ҶеҸЈз“¶дёӯ BпјҺй’ зқҖзҒ«ж—¶дёҚиғҪз”ЁжіЎжІ«зҒӯзҒ«еҷЁзҒӯзҒ« CпјҺз”ЁйҘұе’Ңзўій…ёй’ жә¶ж¶ІйҷӨеҺ»CO2дёӯж··жңүзҡ„HCl DпјҺз”Ёе®№йҮҸ瓶й…ҚеҲ¶жә¶ж¶ІпјҢе®ҡе®№ж—¶дҝҜи§ҶеҲ»еәҰзәҝпјҢжүҖй…Қжә¶ж¶Іжө“еәҰеҒҸе°Ҹ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
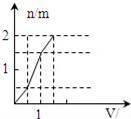
еҗ‘еҗ«1mol HClе’Ңlmol MgSO4зҡ„ж··еҗҲжә¶ж¶ІдёӯеҠ е…Ҙ1mol/Lзҡ„BaпјҲOHпјү2жә¶ж¶ІпјҢдә§з”ҹжІүж·Җзҡ„зү©иҙЁзҡ„йҮҸпјҲnпјүдёҺеҠ е…ҘBaпјҲOHпјү2жә¶ж¶ІдҪ“з§ҜпјҲVпјүй—ҙзҡ„е…ізі»еӣҫжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
XгҖҒYгҖҒZгҖҒWжңүеҰӮеӣҫжүҖзӨәзҡ„иҪ¬еҢ–е…ізі»пјҢеҲҷXгҖҒYеҸҜиғҪжҳҜпјҲгҖҖгҖҖпјү в‘ CгҖҒCOВ В в‘ЎAlCl3гҖҒAlпјҲOHпјү3в‘ўNaгҖҒNa2OВ В В в‘ЈNaOHгҖҒNa2CO3пјҺ
AпјҺв‘ в‘Ўв‘ўВ В BпјҺв‘ в‘Ў CпјҺв‘ўв‘Ј DпјҺв‘ в‘Ўв‘ўв‘Ј
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
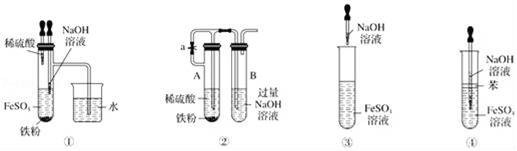
дёӢеҲ—еҗ„еӣҫзӨәдёӯиғҪиҫғй•ҝж—¶й—ҙзңӢеҲ°FeпјҲOHпјү2зҷҪиүІжІүж·Җзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺв‘ в‘Ўв‘ўВ В BпјҺв‘ в‘Ўв‘ЈВ В CпјҺв‘ в‘Ўв‘ўв‘Ј DпјҺв‘Ўв‘ўв‘Ј
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘200mL0.1molвҖўLп№Ј1зҡ„FeпјҲNO3пјү2жә¶ж¶ІдёӯеҠ е…ҘйҖӮйҮҸзҡ„NaOHжә¶ж¶ІпјҢдҪҝFe2+жҒ°еҘҪе®Ңе…ЁжІүж·ҖпјҢиҝҮж»ӨпјҢе°ҸеҝғеҠ зғӯ жІүж·ҖпјҢзӣҙеҲ°ж°ҙеҲҶи’ёе№ІпјҢеҶҚзҒјзғ§еҲ°иҙЁйҮҸдёҚеҶҚеҸҳеҢ–пјҢжӯӨж—¶еӣәдҪ“зҡ„иҙЁйҮҸдёәпјҲгҖҖгҖҖпјү AпјҺ1.44 gВ В BпјҺ1.6 gВ В В CпјҺ2.82 gВ В DпјҺ4.36 g
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷm gеҗ«ж°§еҢ–й“ҒгҖҒж°§еҢ–й“ңжҲ–ж°§еҢ–дәҡй“Ғзҡ„ж ·е“ҒжҠ•е…Ҙзү©иҙЁзҡ„йҮҸжө“еәҰдёә1mol/Lзҡ„2Lзӣҗй…ёдёӯжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢиӢҘеҗ‘зӯүиҙЁйҮҸзҡ„иҜҘж ·е“ҒдёӯйҖҡе…Ҙи¶ійҮҸзҡ„氢气并еҠ зғӯпјҢе……еҲҶеҸҚеә”еҗҺжүҖеҫ—йҮ‘еұһзҡ„иҙЁйҮҸжҳҜпјҲгҖҖгҖҖпјү AпјҺпјҲmп№Ј16пјүgВ В В BпјҺпјҲm+16пјүg CпјҺпјҲmп№Ј32пјүgВ В В DпјҺ16g
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘100mL1mol/Lзҡ„AlCl3жә¶ж¶ІдёӯйҖҗжёҗеҠ е…Ҙжө“еәҰдёә2mol/Lзҡ„NaOHжә¶ж¶ІпјҢиӢҘдә§з”ҹ3.9gзҷҪиүІжІүж·ҖпјҢеҲҷеҠ е…Ҙзҡ„NaOHжә¶ж¶Ізҡ„дҪ“з§ҜеҸҜиғҪдёәпјҲгҖҖгҖҖпјү AпјҺ30mL BпјҺ55mL CпјҺ65mL DпјҺ175mL
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷй’ гҖҒй•ҒгҖҒй“қеҗ„0.3molеҲҶеҲ«еҠ е…Ҙ100mL 1mol/L зҡ„зӣҗй…ёдёӯпјҢеңЁеҗҢжё©еҗҢеҺӢдёӢдә§з”ҹзҡ„ж°”дҪ“дҪ“з§ҜжҜ”жҳҜпјҲгҖҖгҖҖпјү AпјҺ1пјҡ2пјҡ3В BпјҺ6пјҡ3пјҡ2В CпјҺ3пјҡ1пјҡ1В DпјҺ1пјҡ1пјҡ1
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
иӮјпјҲN2H4пјүеҸҲз§°иҒ”ж°ЁпјҢе№ҝжіӣз”ЁдәҺзҒ«з®ӯжҺЁиҝӣеүӮгҖҒжңүжңәеҗҲжҲҗеҸҠзҮғж–ҷз”өжұ пјҢNO2зҡ„дәҢиҒҡдҪ“N2O4еҲҷжҳҜзҒ«з®ӯдёӯеёёз”Ёж°§еҢ–еүӮпјҺиҜ•еӣһзӯ”дёӢеҲ—й—®йўҳ пјҲ1пјүиӮјзҮғж–ҷз”өжұ еҺҹзҗҶеҰӮеӣҫ1жүҖзӨәпјҢиҙҹжһҒдёҠеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”ејҸдёәгҖҖпјҺ пјҲ2пјүзҒ«з®ӯеёёз”ЁN2O4дҪңж°§еҢ–еүӮпјҢиӮјдҪңзҮғж–ҷпјҢе·ІзҹҘпјҡ N2пјҲgпјү+2O2пјҲgпјүв•җ2NO2пјҲgпјүв–іH=п№Ј67.7kJвҖўmolп№Ј1 N2H4пјҲgпјү+O2пјҲgпјүв•җN2пјҲgпјү+2H2OпјҲgпјүв–іH=п№Ј534.0kJвҖўmolп№Ј1 2NO2пјҲgпјүвҮҢN2O4пјҲgпјүв–іH=п№Ј52.7kJвҖўmolп№Ј1 иҜ•еҶҷеҮәж°”жҖҒиӮјеңЁж°”жҖҒеӣӣж°§еҢ–дәҢж°®дёӯзҮғзғ§з”ҹжҲҗж°®ж°”е’Ңж°”жҖҒж°ҙзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸпјҡгҖҖпјҺ пјҲ3пјүиҒ”ж°Ёзҡ„е·Ҙдёҡз”ҹдә§еёёз”Ёж°Ёе’Ңж¬Ўж°Ҝй…ёй’ дёәеҺҹж–ҷиҺ·еҫ—пјҢд№ҹеҸҜз”Ёе°ҝзҙ пјҲCOпјҲNH2пјү2пјүе’Ңж¬Ўж°Ҝй…ёй’ п№Јж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”иҺ·еҫ—пјҢе°ҝзҙ жі•еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖҖпјҺ пјҲ4пјүеҰӮеӣҫ2жүҖзӨәпјҢAжҳҜз”ұеҜјзғӯжқҗж–ҷеҲ¶жҲҗзҡ„еҜҶй—ӯе®№еҷЁпјҢBжҳҜдёҖиҖҗеҢ–еӯҰи…җиҡҖдё”жҳ“дәҺдј зғӯзҡ„йҖҸжҳҺж°”еӣҠпјҺе…ій—ӯK2пјҢе°Ҷеҗ„1mol NO2йҖҡиҝҮK1гҖҒK3еҲҶеҲ«е……е…ҘAгҖҒBдёӯпјҢеҸҚеә”иө·е§Ӣж—¶AгҖҒBзҡ„дҪ“з§ҜзӣёеҗҢеқҮдёәa LпјҺ
в‘ иӢҘе№іиЎЎеҗҺеңЁAе®№еҷЁдёӯеҶҚе……е…Ҙ0.5mol N2O4пјҢеҲҷйҮҚж–°еҲ°иҫҫе№іиЎЎеҗҺпјҢе№іиЎЎж··еҗҲж°”дёӯNO2зҡ„дҪ“з§ҜеҲҶж•°гҖҖгҖҖпјҲеЎ«вҖңеҸҳеӨ§вҖқвҖңеҸҳе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқпјүпјҺ в‘ЎиӢҘжү“ејҖK2пјҢе№іиЎЎеҗҺBе®№еҷЁзҡ„дҪ“з§Ҝзј©иҮі0.4a LпјҢеҲҷжү“ејҖK2д№ӢеүҚпјҢж°”зҗғBдҪ“з§ҜдёәгҖҖгҖҖLпјҺ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢжҹҗж°ҙжә¶ж¶ІMдёӯеӯҳеңЁзҡ„зҰ»еӯҗжңүпјҡNa+гҖҒA2п№ЈгҖҒHAп№ЈгҖҒH+гҖҒOHп№ЈпјҢеӯҳеңЁзҡ„еҲҶеӯҗжңүH2OгҖҒH2AпјҺж №жҚ®йўҳж„Ҹеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҶҷеҮәй…ёH2Aзҡ„з”өзҰ»ж–№зЁӢејҸгҖҖпјҺ пјҲ2пјүиӢҘжә¶ж¶ІMз”ұ10mL 2molвҖўLп№Ј1NaHAжә¶ж¶ІдёҺ2molвҖўLп№Ј1NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲиҖҢеҫ—пјҢеҲҷжә¶ж¶ІMзҡ„pHгҖҖгҖҖ7пјҲеЎ«вҖңпјһвҖқгҖҒвҖңпјңвҖқжҲ–вҖң=вҖқпјүпјҢжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰз”ұеӨ§еҲ°е°ҸйЎәеәҸдёәгҖҖпјҺ е·ІзҹҘKspпјҲBaAпјү=1.8Г—10п№Ј10пјҢеҗ‘иҜҘж··еҗҲжә¶ж¶ІдёӯеҠ е…Ҙ10mL 1molвҖўLп№Ј1BaCl2жә¶ж¶ІпјҢж··еҗҲеҗҺжә¶ж¶Ідёӯзҡ„Ba2+жө“еәҰдёәгҖҖ molвҖўLп№Ј1пјҺ пјҲ3пјүиӢҘжә¶ж¶ІMз”ұpH=3зҡ„H2Aжә¶ж¶ІV1 mLдёҺpH=11зҡ„NaOHжә¶ж¶ІV2 mLж··еҗҲеҸҚеә”иҖҢеҫ—пјҢж··еҗҲжә¶ж¶І
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ | |||||||||
|
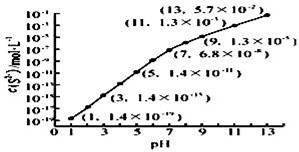
з ”з©¶зЎ«е…ғзҙ еҸҠе…¶еҢ–еҗҲзү©зҡ„жҖ§иҙЁе…·жңүйҮҚиҰҒж„Ҹд№үпјҺ пјҲ1пјүв‘ зЎ«зҰ»еӯҗзҡ„з»“жһ„зӨәж„ҸеӣҫдёәгҖҖгҖҖпјҺ в‘ЎеҠ зғӯж—¶пјҢзЎ«е…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„жө“жә¶ж¶ІдёҺжңЁзӮӯеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡгҖҖгҖҖпјҺ пјҲ2пјү25в„ғпјҢеңЁ0.10molвҖўLп№Ј1H2Sжә¶ж¶ІдёӯпјҢйҖҡе…ҘHClж°”дҪ“жҲ–еҠ е…ҘNaOHеӣәдҪ“д»Ҙи°ғиҠӮжә¶ж¶ІpHпјҢжә¶ж¶ІpHдёҺcпјҲS2п№ЈпјүВ е…ізі»еҰӮеҸіеӣҫпјҲеҝҪз•Ҙжә¶ж¶ІдҪ“з§Ҝзҡ„еҸҳеҢ–гҖҒH2Sзҡ„жҢҘеҸ‘пјүпјҺ в‘ pH=13ж—¶пјҢжә¶ж¶Ідёӯзҡ„cпјҲH2Sпјү+cпјҲHSп№Јпјү=гҖҖгҖҖmolвҖўLп№Ј1пјҺ
в‘Ўжҹҗжә¶ж¶Іеҗ«0.020molвҖўLп№Ј1Mn2+гҖҒ0.10molвҖўLп№Ј1H2SпјҢеҪ“жә¶ж¶ІpH=гҖҖгҖҖж—¶пјҢMn2+ејҖе§ӢжІүж·ҖпјҺ1е·ІзҹҘпјҡKspпјҲMnSпјү=2.8Г—10п№Ј13] пјҲ3пјү25в„ғпјҢдёӨз§Қй…ёзҡ„з”өзҰ»е№іиЎЎеёёж•°еҰӮиЎЁпјҺ и¶ійҮҸNaHSO3жә¶ж¶ІдёҺNaHCO3жә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖҖгҖҖпјҺ
|
||||||||||
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
зўій…ёзӣҗжҳҜйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷеҸҠиҜ•еүӮпјҺ пјҲ1пјүеҗ‘0.02mol/L Na2CO3жә¶ж¶ІдёӯеҠ е…ҘзӯүдҪ“з§Ҝзҡ„CaCl2жә¶ж¶ІиӢҘејҖе§ӢжңүжІүж·Җз”ҹжҲҗпјҢеҲҷжүҖйңҖCaCl2жә¶ж¶Ізҡ„жө“еәҰжңҖе°Ҹдёә гҖҖгҖҖпјҲе·ІзҹҘ25в„ғж—¶KSPпјҲCaCO3пјү=2.8Г—10п№Ј9пјүпјҺйҖҡиҝҮжңҖж–°е·ҘиүәеҸҜеҲ¶еҫ—зәізұіпјҲ50nmпјүCaCO3зІүжң«пјҢи®ҫи®Ўз®Җ еҚ•зҡ„е®һйӘҢж–№жі•иҜҒжҳҺиҜҘзү©иҙЁзҡ„дә§з”ҹгҖҖгҖҖпјҺ пјҲ2пјүе·ІзҹҘ0.1mol/L NaHCO3жә¶ж¶Ізҡ„pH=8пјҺжҹҗеӯҰд№ е…ҙи¶Је°Ҹз»„жҺўз©¶е®һйӘҢе®ӨеҲ¶еҫ—зҡ„зәҜзўұеҗ«е°‘йҮҸNaClпјҢиҝҳеҸҜиғҪеҗ«е°‘йҮҸNaHCO3пјҺдёәжөӢе®ҡзәҜзўұзҡ„зәҜеәҰпјҢз”Ёз”өеӯҗеӨ©е№іеҮҶзЎ®з§°еҸ–ж ·е“Ғmе…ӢпјҢе°Ҷе…¶ж”ҫе…Ҙй”ҘеҪўз“¶дёӯпјҢз”ЁйҖӮйҮҸи’ёйҰҸж°ҙжә¶и§ЈпјҢж»ҙеҠ 2ж»ҙй…ҡй…һпјҢз”Ёc mol/Lзҡ„ж ҮеҮҶзӣҗй…ёж»ҙе®ҡиҮіжә¶ж¶Із”ұжө…иүІеҸҳжҲҗж— иүІпјҢдё”еҚҠеҲҶй’ҹдёҚеҸҳиүІпјҢж»ҙе®ҡиҝҮзЁӢдёӯж— ж°”дҪ“дә§з”ҹпјҢжүҖз”Ёзӣҗй…ёзҡ„дҪ“з§ҜдёәV1mLпјҺ в‘ з”ЁзҰ»еӯҗж–№зЁӢејҸдҫҝжҳҜжӯӨж—¶еҸ‘з”ҹзҡ„еҸҚеә”гҖҖгҖҖпјҺ в‘Ўж ·е“ҒдёӯNa2CO3иҙЁйҮҸеҲҶж•°зҡ„иЎЁиҫҫејҸжҳҜгҖҖпјҺ в‘ўеҗ‘й”ҘеҪўз“¶жә¶ж¶Ідёӯ继з»ӯж»ҙеҠ 2ж»ҙз”Іеҹәж©ҷпјҢз”ЁеҗҢжө“еәҰзҡ„зӣҗ酸继з»ӯж»ҙе®ҡиҮіз»ҲзӮ№пјҢжүҖз”Ёзӣҗй…ёзҡ„дҪ“з§ҜдёәV2mLпјҺж»ҙе®ҡз»ҲзӮ№ж—¶пјҢжә¶ж¶ІйўңиүІзҡ„еҸҳеҢ–жҳҜгҖҖгҖҖпјҢдё”еҚҠеҲҶй’ҹеҶ…дёҚеҸҳиүІпјӣиӢҘж ·е“Ғдёӯеҗ« NaHCO3пјҢеҲҷV1гҖҖгҖҖV2пјҲеЎ«вҖңпјһвҖқгҖҒвҖңпјңвҖқжҲ–вҖң=вҖқпјүпјҺ
|
|
- 2019еұҠй«ҳдёүдёҠеҶҢ第дәҢж¬ЎжЈҖжөӢеҢ–еӯҰиҜ•еҚ·пјҲйҷ•иҘҝзңҒиҘҝе®үеёӮй•ҝе®үеҢә第дёҖдёӯеӯҰпјү
- жөҷжұҹ2018е№ҙй«ҳдёҖеҢ–еӯҰдёҠеӯҰжңҹй«ҳиҖғжЁЎжӢҹеңЁзәҝе…Қиҙ№иҖғиҜ•
- 2019е№ҙиҮі2020е№ҙй«ҳдәҢ9жңҲжңҲиҖғеҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲеұұиҘҝзңҒиҝҗеҹҺеёӮжҷҜиғңдёӯеӯҰпјү
- 2018-2019е№ҙй«ҳдёҖдёҠеҶҢ第дёүж¬ЎжңҲиҖғеҢ–еӯҰпјҲеӣӣе·қзңҒеҸҢжөҒеҺҝжЈ ж№–дёӯеӯҰпјү
- дә‘еҚ—й«ҳдәҢеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2019е№ҙдёӢеҶҢпјүиҜ•еҚ·е®Ңж•ҙзүҲ
- 2018е№ҙиҮі2019е№ҙй«ҳдёҖеҗҺеҚҠжңҹ第дәҢж¬Ўйҳ¶ж®өиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲй»‘йҫҷжұҹзңҒеӨ§еәҶеёӮ第дёҖдёӯеӯҰпјү
- иҙөе·һ2020е№ҙй«ҳдәҢеҢ–еӯҰеүҚеҚҠжңҹжңҹжң«иҖғиҜ•е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- иҘҝи—Ҹ2018е№ҙй«ҳдәҢеҢ–еӯҰеүҚеҚҠжңҹжңҹжң«иҖғиҜ•е®Ңж•ҙиҜ•еҚ·





 В B
В B
 В C
В C