2019内蒙古高一上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
关于金属钠的叙述中,正确的是( ) A.钠是银白色金属,熔点低,硬度大 B.钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠 C.加热时,金属钠剧烈燃烧,产生黄色火焰 D.金属钠着火可以用泡沫灭火器或用水灭火
|
|
| 2. | 详细信息 |
|
将一块铝箔用砂纸打磨表面后,在酒精灯上加热至熔化,以下说法正确的是( ) A.熔化物滴落 B.熔化的是Al2O3 C.熔化的金属铝非常黏稠所以不滴落 D.熔化而不滴落的原因是氧化膜的熔点高,兜住了熔化的铝
|
|
| 3. | 详细信息 |
|
某金属元素由氧化物转变为单质,则该金属元素( ) A.一定被还原 B.一定被氧化 C.可能被氧化,也可能被还原 D.既不被氧化,也不被还原
|
|
| 4. | 详细信息 |
|
在反应3NO2+H2O===2HNO3+NO中,发生还原反应和氧化反应的物质的量之比为( ) A.3∶1 B.1∶3 C.1∶2 D.2∶1
|
|
| 5. | 详细信息 |
|
若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的( ) A.Fe3+、Mg2+、Cl-、Na+ B.Ba2+、Mg2+、HCO C.NO
|
|
| 6. | 详细信息 |
|
等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法中正确的是( ) A.第一块钠失去电子多 B.两块钠失去电子一样多 C.第一块钠的反应产物质量小 D.两块钠的反应产物质量一样大
|
|
| 7. | 详细信息 |
|
在反应H2S+H2SO4===S↓+SO2↑+2H2O中,若有32 g硫生成,则转移电子为( ) A.6 mol B.4 mol C.3 mol D.2 mol
|
|
| 8. | 详细信息 |
|
下列反应既属于离子反应,又属于氧化还原反应的是( ) A.Fe +CuSO4 C.AgNO3 +NaCl
|
|
| 9. | 详细信息 |
|
下列反应的离子方程式正确的是( ) A.Cu与FeCl3溶液反应:Cu+2Fe3+=== Fe2++Cu2+ B.铁与稀H2SO4反应:Fe+2H+=== Fe2++H2↑ C.铝与氢氧化钠溶液反应:Al + 2OH-=== AlO D.Na与水反应:Na+2H2O=== Na++2OH-+H2↑
|
|
| 10. | 详细信息 |
|
下列各组物质互相作用时,生成物不随反应条件或反应物的量变化而变化的是( ) A.Na2CO3和HCl B.NaOH和CO2 C.Na和O2 D.NaHCO3和NaOH
|
|
| 11. | 详细信息 |
|
等质量的钠进行下列实验,其中产生氢气最多的是( ) A.将钠放入足量水中 B.将钠放入足量稀硫酸中 C.将钠用刺有小孔的铝箔包好并放入足量水中 D.将钠放入硫酸铜溶液中
|
|
| 12. | 详细信息 |
|
被称为万能还原剂的NaBH4溶于水,并和水反应:NaBH4+2H2O===NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)( ) A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂 C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量之比为1∶1
|
|
| 13. | 详细信息 |
|
已知下列几个反应的化学方程式: ①2KI+Cl2===2KCl+I2; ②2FeCl3+2HI===2FeCl2+I2+2HCl; ③2FeCl2+Cl2===2FeCl3; ④I2+SO2+2H2O===H2SO4+2HI; 下列有关物质的氧化性的强弱排列顺序中正确的是( ) A.Cl2>Fe3+>I2>SO2 B.Cl2>I2>Fe3+>SO2 C.Cl2>Fe3+>SO2>I2 D.Fe3+>I2>Cl2>SO2
|
|
| 14. | 详细信息 |
|
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( ) A.0.1 mol Na2O2中,阴离子的个数为0.2NA B.2.3g金属钠与足量的水反应得到的电子数为0.1NA C.标准状况下,22.4 L CO2 与足量的Na2O2反应,转移的电子数为 NA D . 常温常压下,22.4 L氯气与足量Na充分反应,转移的电子数为2 NA
|
|
| 15. | 详细信息 |
|
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( ) A. 甲、乙中都是铝过量 B. 甲中酸过量,乙中铝过量 C. 甲中酸过量,乙中碱过量 D. 甲中铝过量,乙中碱过量
|
|
| 16. | 详细信息 | ||||||||||||||||||||
|
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
|
|||||||||||||||||||||
| 17. | 详细信息 |
|
由钠、镁、铝、铁四种金属单质中的两种组成的合金共24g,跟足量的盐酸反应产生11.2L氢气(标准状况),那么此合金中一定含有的金属是( ) A.Na B.Mg C.Al D.Fe
|
|
| 18. | 详细信息 |
|
.2 mol Na2O2与2mol NaHCO3固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( ) A.NaOH和Na2CO3 B.NaOH C.Na2CO3 D.NaOH、Na2O2和Na2CO3
|
|
| 19. | 详细信息 |
|
水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32-+O2+xOH-===Fe3O4+S4O62-+2H2O,有关说法正确的是( ) A.x=2 B.Fe2+、S2O32-都是还原剂 C.每转移4 mol电子,有3mol Fe2+被氧化 D.每生成1 mol Fe3O4,反应中转移电子2 mol
|
|
| 20. | 详细信息 |
|
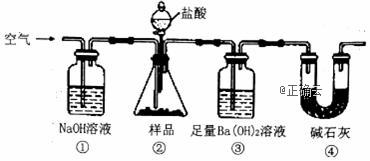
实验室按如图所示装置测定纯碱(含少量NaC1)的纯度。下列说法不正确的是( )
A. 滴入盐酸前,应将装置中含有CO2的空气排尽 B. 装置①、④的作用是防止空气中的CO2进入装置③ C. 必须在装置②、③间添加盛有饱和 NaHCO3溶液的洗气瓶 D. 反应结束时,应再通入空气将装置②中CO2转移到装置③中
|
|
| 21. | 详细信息 |
|
已知: Fe2O3+2Al (1)在该反应中____元素的化合价升高,该元素的原子_____电子,被____; (2)在该反应中______元素的化合价降低,该元素的原子________电子,被________。 (3)该反应中,Fe2O3发生了________反应,Al发生了________反应。 (4)_______是氧化剂,_______是还原剂,_______是氧化产物,_______是还原产物。 (5)用单线桥标出电子转移的方向和数目______________________________________。
|
|
| 22. | 详细信息 |
|
A、B、C、D、E五种物质的焰色反应都显黄色,A、B与水反应都有气体放出,A与水的反应放出的气体只具有氧化性,同时都生成溶液C,C与少量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能变成D。 (1)写出下列物质的化学式:A____________、C____________、E_____________。 (2)B与水反应的离子方程式是:______________________________________________。 (3)D溶液中通入CO2的离子方程式:__________________________________________。 (4)7.8g的A加入到足量的硫酸铜溶液中,标况下,产生气体的体积为________L, 生成沉淀的质量为________g。
|
|
| 23. | 详细信息 |
|
Ⅰ.选择不同的试剂或方法除去下列物质中的杂质(括号内为杂质),写出有关反应的方程式: (1)Mg(Al) 离子方程式:_______________________________________________。 (2)Cu(Al) 离子方程式:________________________________________________。 (3)Na2CO3固体(NaHCO3固体) 化学方程式:________________________________。 (4)Na2CO3溶液(NaHCO3溶液) 离子方程式:________________________________。 Ⅱ.配平下列离子方程式: (1)_____H2S +_____Cr2O72- + _____H+ = _____S↓+_____Cr3+ +_____H2O (2)_____C2O42- +_____MnO4- + ______ = _____CO2 + ____Mn2+ + ____H2O
|
|
| 24. | 详细信息 |
|
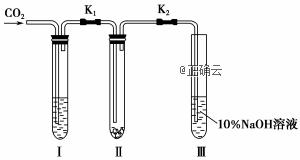
实验甲:干燥的二氧化碳和过氧化钠的反应。在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2。在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化。 实验乙:潮湿的二氧化碳和过氧化钠的反应。在试管Ⅰ内装入试剂Y,其他操作同实验甲。观察到木条复燃,且Ⅱ中的淡黄色变为白色。 试回答下列问题: (1)Na2O2与水反应的离子方程式____________________________________。 (2)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是____________________。 (3)在实验甲中,试剂X是____________; 在实验乙中,试剂Y是____________(填化学式)。 (4)根据上述两个实验现象,得到的结论是____________________________________。 (5)试管Ⅲ中的NaOH溶液的作用是___________________________________。 (6)为了确保实验的准确性,制备CO2所用的反应物最好选用_______(填编号)。 A.大理石 B.小苏打 C.盐酸 D.稀硫酸
|
|
- 杭州市高二化学期末考试(2019年下册)试卷带解析及答案
- 2019-2020年高二上半期期中考试化学免费试卷完整版(福建省莆田九中)
- 高二下册期末教育教学质量监测化学在线考试题带答案和解析(2019-2020年云南省保山市中小学)
- 海南省华中师范大学海南附属中学2021届高三上半年第四次月考化学免费试题带答案和解析
- 高一下半年期末教学质量检测化学试卷带参考答案和解析(2019-2020年广西壮族自治区北海市)
- 北京市昌平区2020-2021年高一上期期末考试化学题带参考答案
- 湖北省黄冈市2020-2021年高二上期期末调研考试化学试卷在线练习
- 河南省郑州市第一中学2021届高三上半期开学测试化学在线考试题带答案和解析
 为了探究
为了探究


