2017四川高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
与NO3-互为等电子体的是( ) A.SO32- B.BF3 C.CH4 D.NO2
|
|
| 2. | 详细信息 |
|
下列有关金属晶体的说法错误的是( ) A.温度越高,金属的导电性越差 B.金属晶体中非密置层在三维空间可形成两种堆积方式,其配位数都是6 C.镁型堆积和铜型堆积是密置层在三维空间形成的两种堆积方式,其配位数都是12 D.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
|
|
| 3. | 详细信息 |
|
下列说法正确的是(NA为阿伏加德罗常数)( ) A.124 g P4含有P-P键的个数为4NA B.12 g石墨中含有C-C键的个数为3NA C.12 g金刚石中含有C-C键的个数为2NA D.60gSiO2中含Si-O键的个数为2NA
|
|
| 4. | 详细信息 |
|
下列实验操作和数据记录都正确的是( ) A.用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2 g B.用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL C.用干燥的广泛pH试纸测稀盐酸的pH=3.2 D.用10 mL量筒量取NaCl溶液,体积为9.2 mL
|
|
| 5. | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是( ) A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- C.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN- D.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
|
|
| 6. | 详细信息 |
|
已知:H2(g)+1/2O2(g)===H2O(l) ΔH1=-285.8 kJ·mol-1 ① H2(g)===H2(l) ΔH2=-0.92 kJ·mol-1 ② O2(g)===O2(l) ΔH3=-6.84 kJ·mol-1 ③ H2O(g)===H2O(l) ΔH4=-44 kJ·mol-1 ④ 下列说法正确的是( ) A.上述四个反应都是吸热反应 B.1 mol液态H2的能量大于1 mol气态H2的能量 C.H2的燃烧热ΔH为-285.8 kJ·mol-1 D.火箭中液氢燃烧的热化学方程式为H2(l)+1/2O2(l)===H2O(g) ΔH=-285.8 kJ·mol-1
|
|
| 7. | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是( ) ①由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅 ②增大压强可加快SO2转化为SO3的速率 ③黄绿色的氯水光照后颜色变浅 ④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 ⑤对平衡体系H2(g)+I2(g) A.①③④ B.②⑤ C.①⑤ D.①②④
|
|
| 8. | 详细信息 |
|
下列现象与氢键无关的是( ) A.小分子的醇、羧酸可以和水以任意比互溶 B.冰的密度比液态水的密度小 C.邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 D.水分子是很稳定的分子,加热到很高的温度都难以分解
|
|
| 9. | 详细信息 |
|
下列说法正确的是 ( ) A.熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体 B.某单质熔点97.81℃,是热和电的良导体,该晶体最可能是分子晶体 C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子 D.固态金属单质都是金属晶体,金属晶体含有金属键;非金属单质晶体都是分子晶体,分子晶体主要含有共价键、范德华力,有些分子晶体还含有氢键
|
|
| 10. | 详细信息 |
|
下列有关问题,与盐类的水解无关的是( ) A.NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 B.用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 C.实验室盛放氢氧化钠溶液的试剂瓶不能用磨口玻璃塞 D.加热蒸干AlCl3溶液得到Al(OH)3固体
|
|
| 11. | 详细信息 |
|
K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( ) A.在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大 B.室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大 C.25℃时,pH均为4的盐酸和NH4I溶液中KW不相等 D.2SO2+O2
|
|
| 12. | 详细信息 |
|
下列各组中,用惰性电极电解下列每种电解质溶液时只生成氢气和氧气的是( ) A.HCl、CuCl2、Ba(OH)2 B.NaOH、CuSO4、H2SO4 C.NaOH、H2SO4、Ba(OH)2 D.NaBr、H2SO4、Ba(OH)2
|
|
| 13. | 详细信息 |
|
2003年美国《科学》杂志报道:在超高压下,科学家用激光器将CO2加热到1800K,成功制得了类似石英的CO2原子晶体。下列关于CO2晶体的叙述中不正确的是( ) A.晶体中C、O原子个数比为1∶2 B.该晶体的熔点和沸点高、硬度大 C.晶体中C—O—C键角为180° D.晶体中C、O原子最外层都满足8电子结构
|
|
| 14. | 详细信息 |
|
解释下列物质性质的变化规律与物质结构因果关系时,与化学键强弱无关的变化规律是( ) A.HF、HCI、HBr、HI的热稳定性依次减弱 B.NaF、NaCl、NaBr、NaI的熔点依次减低 C.F2、C12、Br2、I2的熔、沸点逐渐升高 D.硅的熔沸点小于金刚石的熔沸点
|
|
| 15. | 详细信息 |
|
已知Ca(OH)2的饱和溶液中存在平衡:Ca(OH)2(s) A.升高温度,平衡正向移动 B.向溶液中加入少量碳酸钠粉末能增大钙离子浓度 C.恒温下向溶液中加入CaO,溶液的pH不变 D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
|
|
| 16. | 详细信息 |
|
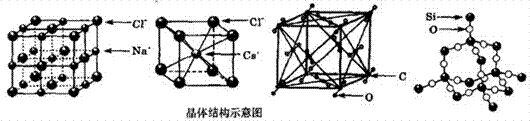
通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示:
下列关于这些晶体结构和性质的叙述不正确的是( ) A.在氯化钠晶体中每个Cl-周围同时吸引6个Na+,在氯化铯晶体中每个Cl-周围同时吸引8个Cs+ B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质 C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 D.在二氧化硅晶体中,硅原子与氧原子个数比为1:2
|
|
| 17. | 详细信息 |
|
下列与化学概念有关的说法或化学用语不正确的是( ) A.用石墨作电极电解NH4Cl溶液的阳极反应式为:2Cl--2e-=Cl2↑ B.由Al、Cu、浓硝酸组成的原电池,其正极反应式为:NO3-+2H++e-= NO2↑+H2O C.由Al、Mg、NaOH组成的原电池,其负极反应式为:Al-3e-+3OH- = Al(OH)3↓ D.Mg(OH)2固体在溶液中存在溶解平衡: Mg(OH)2(s)
|
|
| 18. | 详细信息 |
|
374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水( ) A.显中性,pH等于7 B.表现出非极性溶剂的特性 C.显酸性,pH小于7 D.表现出极性溶剂的特性
|
|
| 19. | 详细信息 |
|
已知:CaCO3+2HCl = CaCl2+CO2↑+H2O ΔH<0,下列说法不正确的是( ) A.其它条件不变,适当增大盐酸的浓度将加快化学反应速率 B.其它条件不变,适当增加CaCO3的用量将加快化学反应速率 C.反应过程中,化学反应速率将先增大后减小 D.一定条件下反应速率改变,ΔH<0不变
|
|
| 20. | 详细信息 |
|
下列描述正确的是( )
A.图1可能表示压强对可逆反应A(g)+2B(g) B.图2可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 C.据图3,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH到4左右 D.当反应COCl2(g)
|
|
| 21. | 详细信息 |
|
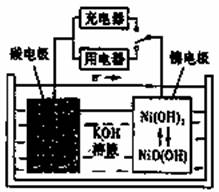
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
A.放电时,负极的电极反应为:H2-2e-=2H+ B.充电时,阳极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O C.放电时,OH-移向镍电极 D.充电时,将电池的碳电极与外电源的正极相连
|
|
| 22. | 详细信息 |
|
现有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,Y、Z、W、Q形成的简单离子具有相同的电子层结构,YX3、X2Z、X2Z2、W2Z、W2Z2都是常见的化合物,其中YX3在常温下呈气态,能使酚酞溶液变红色。下列有关推断正确的是( ) A.简单离子半径:Q>W>Z>Y>X B.YX3分子的VSEPR模型为四面体 C.X能分别与Y、Z、W形成共价化合物 D.Y、W、Q的最高价氧化物对应的水化物两两之间一定相互反应
|
|
| 23. | 详细信息 |
|
下列说法中正确的是( ) A.常温下,在pH=3的CH3COOH溶液和pH=3的H2SO4溶液中,水的电离程度前者小于后者 B.0.1 mol•L﹣1 CH3COONa溶液与0.05 mol•L﹣1盐酸等体积混合后的酸性溶液中:c(Cl﹣)>c(CH3COO﹣)>c(CH3COOH)>c(H+) C.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=9 ∶2(忽略溶液混合后的体积变化) D.常温下,在10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20 mL(忽略溶液混合后的体积变化)
|
|
| 24. | 详细信息 | ||||||||||||||||
|
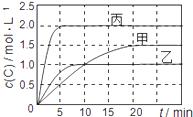
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)
下列说法正确的是 ( ) A.由图可知:T1<T2,且该反应为吸热反应 B.T1时该反应的平衡常数K=7.2 C.前10min甲、乙、丙三个容器中A的平均反应速率:v(A)乙<v(A)甲<v(A)丙 D.平衡时A的质量m:m乙<m甲<m丙
|
|||||||||||||||||
| 25. | 详细信息 | ||||||||||||
|
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E、F用所对应的元素符号表示)
(1)F基态原子核外价电子排布式是_________________________________________________ (2)A、B、E三种元素电负性由大到小排列顺序为________________________ (3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为____________________________
(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知: AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol 2BO2(g) 写出AH4和B2O4反应的热化学方程式____________________________________________________ (5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度__________________________g·cm-3(不必计算出结果)。 (6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为_______________ (7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式__________________________________________________________________________ (8)某学生所做的有关F元素的实验流程如下图: F单质 请书写第⑤步反应的离子方程式:_________________________________________________________
|
|||||||||||||
| 26. | 详细信息 | ||||||
|
Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。 (1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。 (2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。 ①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________ ②请分析CaSO4转化为CaCO3的原理: ______________________________________________________ Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________ (2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________ (3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。 a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸 b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸 c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
|
|||||||
| 27. | 详细信息 |
|
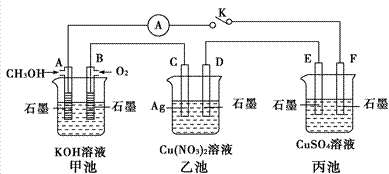
Ⅰ.某校化学课外活动小组进行测定果汁中维生素C(分子式是C6H8O6)含量实验,下面是他们的实验过程及分析报告,请根据此报告填写有关空白。 (1)实验目的:测定××牌软包装鲜橙汁维生素C含量。 (2)实验原理:C6H8O6+I2→C6H6O6+2H++2I- (3)实验用品和试剂: ①仪器和用品(自选,略) ②试剂:浓度为7.50×10-3mol・L-1的标准碘(水)溶液,指示剂,蒸馏水等。 (4)实验过程: ①洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,用标准液润洗的仪器是______________________。 ②打开橙汁包,目测:颜色―橙黄色,澄清度―好,将酸式滴定管用橙汁润洗2~3遍,移取20.00mL橙汁入锥形瓶,向瓶中加入2滴指示剂,该指示剂的名称是___________________________。 ③用左手操作滴定管,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化。滴定至终点时的现象是 ___________________________________________________________________。 (5)数据记录和处理:(设计出表格,将三次滴定所得数据都填入表格中),若经数据处理,滴定中消耗标准碘溶液体积平均值为20.00mL,则此橙汁中维生素C的含量是__________________mg·L-1。 (6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果 _________________。(填“偏高”“偏低”或“无影响”)。 Ⅱ.某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。
请回答下列问题: (1)甲池为__________(填“原电池”“电解池”),A电极的电极反应式为_________________________ (2)丙池中F电极为_____________(填“正极”“负极”“阴极”或“阳极”),该池的总反应方程式为 ____________________________________________________________ (3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为_________mL(标准状况)。 (4)一段时间后,断开开关K。下列物质能使乙池恢复到反应前浓度的是_________(填选项字母)。 A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
|
|
| 28. | 详细信息 |
|
肼(N2H4)是一种高能燃料,在工业生产中用途广泛。 (1)肼(N2H4)也可与NO2发生反应,产物均不污染环境。请写出反应方程式: ______________________________________________________________________________。 (2)肼性质与氨气相似,易溶于水,可发生如下电离过程: N2H4 + H2O ① 常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中由水电离产生的c(H+)为__________。 ② 已知在相同条件下过程I的进行程度大于N2H5+的水解程度。常温下,若0.2 mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,则此时溶液呈_________性,溶液中N2H5+、Cl-、OH-、H+、N2H4浓度由大到小的顺序为_______________________________________________。
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如图): 温度较低时主要发生反应a:N2H4(g) + O2(g) 温度较高时主要发生反应b:N2H4(g) + 2O2(g) ①若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1__________K2。(填“>”、“<”或“=”) ②某温度下,容积固定的密闭容器中,下列描述可说明反应a达到平衡的是________________。 A.v(N2) = v(N2H4) B.c(N2H4): c(O2):c( N2) = 1:1:1 C.混合气体的密度不再改变 D.体系的压强不再发生变化 E.混合气体的平均相对分子质量不再发生变化 ③1000℃,反应b达到平衡时,下列措施能使容器中 A.恒容条件下充入He B.增大容器体积 C.恒容条件下下充入N2H4 D.使用催化剂
|
|