2019宁夏高二下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
下列表示物质结构的化学用语正确的是( ) A.H2O2的电子式: C.次氯酸的结构式 H—Cl—O D.CO2的分子模型示意图:
|
|
| 2. | 详细信息 |
|
有关杂化轨道理论的说法不正确的是 A. 杂化前后的轨道数不变,但轨道的形状发生了改变 B.杂化轨道全部参加形成化学键 C. sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° D. 四面体形、三角锥形的结构可以用sp3杂化轨道解释
|
|
| 3. | 详细信息 |
|
具有下列电子排布式的原子中,半径最大的是( ) A.1s22s22p63s23p1 B.1s22s22p3 C.1s22s22p5 D.1s22s22p63s23p4
|
|
| 4. | 详细信息 |
|
下列说法正确的是( ) A.第二周期元素的第一电离能随原子序数递增依次增大 B.CO2、SO2都是直线形的非极性分子 C..氟元素的电负性最大 D.CH2
|
|
| 5. | 详细信息 |
|
对于排布在2s轨道上的电子,不能确定的是 A. 电子所在的电子层 B. 电子的自旋方向 C. 电子云的形状 D. 电子云的伸展方向
|
|
| 6. | 详细信息 |
|
下列各组元素的性质正确的是( ) A.第一电离能:B>Al>Ga B.电负性:F>N>O D.最高正价:F>S>Si D.原子半径:P>N>C
|
|
| 7. | 详细信息 |
|
下列关于价电子构型3s23p4的描述正确的是( ) A.它的元素符号为O B.它的核外电子排布式为1s22s22p63s23p4 C.常温下,可以与H2化合生成液态化合物 D.其电子排布图为
|
|
| 8. | 详细信息 |
|
下列化学键中,键的极性最强的是( ) A.C—F B.C—O C.C—N D.C—C
|
|
| 9. | 详细信息 |
|
下列各组微粒中,互为等电子体的是 A. H3O+和OH- B. SO42-和PO43- C. NO3-和NO2- D. CH3+和NH4+
|
|
| 10. | 详细信息 |
|
下列分子和离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( ) A.NH4+ B.PH3 C.H3O+ D.OF2
|
|
| 11. | 详细信息 |
|
下列叙述正确的是( ) ①离子化合物可能含有共价键 ②构成分子的微粒一定含有共价键 ③共价化合物中不可能含有离子键 ④非极性分子中一定含有非极性键 A.①② B.①③ C.②④ D.③④
|
|
| 12. | 详细信息 |
|
下列叙述中正确的是( ) A.NH3、CO、CO2都是极性分子 B.CH4、CCl4都是含有极性键的非极性分子 C.HF、HCl、HBr、HI的稳定性依次增强 D.CS2、H2O、C2H2都是直线形分子
|
|
| 13. | 详细信息 |
|
下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是( ) A.CCl4、SiCl4、SiH4 B.H2S、NF3、CH4 C.BCl3、CH2===CHCl、环已烷 D.SO3、C6H6(苯)、CH3C≡CH
|
|
| 14. | 详细信息 |
|
根据“相似相溶”规律和实际经验,下列叙述不正确的是 ( ) A. 白磷(P4)易溶于CS2,但难溶于水 B. NaCl易溶于水,难溶于CCl4 C. 碘易溶于苯,微溶于水 D. 卤化氢易溶于水,也易溶于CCl4
|
|
| 15. | 详细信息 |
|
在分子中,羰基与甲基碳原子成键时所采取的杂化方式分别为( ) A.sp2杂化;sp2杂化 B.sp3杂化;sp3杂化 C.sp2杂化;sp3杂化 D.sp杂化;sp3杂化
|
|
| 16. | 详细信息 |
|
下列现象与氢键有关的是( )
②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素的溶、沸点比醋酸的高 ⑤邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的低 ⑥水分子在较高温度下也很稳定. A. ①②③④⑤⑥ B. 仅①②③④⑤ C. 仅①②③④ D. 仅①②③
|
|
| 17. | 详细信息 |
|
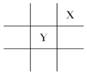
短周期元素X、Y在周期表中的相对位置如图所示,且已知X基态原子的价电子排布为nsnnpn+1,下列说法不正确的是( ) A.X元素的电负性大于Y B.X元素的第一电离能大于Y C.X在周期表中位于第二周期第ⅢA族 D.原子半径Mg>Y
|
|
| 18. | 详细信息 |
|
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N
A. N4属于一种新型的化合物 B. N4分子中存在非极性键 C. N4和N2是同分异构体 D. 1 mol N4转变成N2将吸收882 kJ热量
|
|
| 19. | 详细信息 |
|
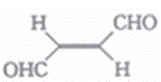
下列关于化合物A(结构简式如图)的叙述中正确的是
A. 分子中只有极性键 B. 该分子中三种元素的电负性:H>C>O C. 分子中有σ键和兀键 D. 该分子在水中的溶解度小于甲烷在水中的溶解度
|
|
| 20. | 详细信息 |
|
下列各组原子中,彼此化学性质一定相似的是( ) A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 C.2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子 D.最外层都只有一个电子的X、Y原子
|
|
| 21. | 详细信息 |
|
下列说法中正确的是( ) A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子 B.水很稳定是因为水中含有大量的氢键所致 C.H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C原子分别采取sp、sp2、sp3杂化 D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-
|
|
| 22. | 详细信息 | ||||||||||||||||||
|
以下是A、B、C、D、E五种短周期元素的某些性质:
下列判断正确的是( ) A.C、D、E的氢化物的稳定性顺序为C>D>E B.元素A的最外层轨道中无自旋方向相同的电子 C.元素B、C不可能形成化合物 D.与元素B处于同周期且在该周期中第一电离能最小的元素的单质能与H2O发生置换反应
|
|||||||||||||||||||
| 23. | 详细信息 |
|
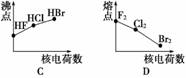
下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 ( )
|
|
| 24. | 详细信息 |
|
Co(Ⅲ)的八面体配合物CoClm·nNH3,若1mol配合物与AgNO3作用生成1molAgCl沉淀,则m、n的值是 ( ) A.m=1,n=4 B.m=3,n=4 C.m=5,n=1 D.m=3,n=5
|
|
| 25. | 详细信息 |
|
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( ) A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性 C. 气态氢化物的热稳定性:W<Y D. 最高价氧化物的水化物的酸性:Y>Z
|
|
| 26. | 详细信息 |
|
(1)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_____、_______、________。 (2)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填序号)________________。 (3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”): HClO3________HClO4;
|
|
| 27. | 详细信息 | ||||||||
|
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
|
|||||||||
| 28. | 详细信息 |
|
(1)CS2是一种常用的溶剂,CS2的分子中存在________个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是________,键长较长的是________。 (2)SO2与CO2分子的立体结构分别是________和________,相同条件下两者在水中的溶解度较大的是________(写分子式),理由是__________________________________________________________。 (3)醋酸的球棍模型如图1所示。
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是________(填选项字母) A.极性键 B.非极性键 C.配位键 D.金属键
|
|
| 29. | 详细信息 |
|
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素。AC2是非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子在外界。根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) (1)A、B、C的第一电离能由小到大的顺序为________________________________; (2)B的氢化物的分子立体构型是__________________;;其中心原子采取________________杂化。 (3)写出化合物AC2的电子式为____________________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为_______________。 (4)E的核外电子排布式是__________________,ECl3形成的配合物的化学式为_________________
|
|