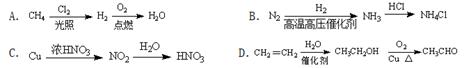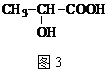2020江苏高一下学期苏教版高中化学期末考试
| 1. | 详细信息 |
|
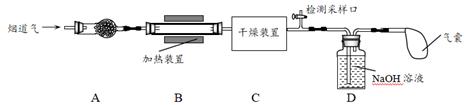
某处工厂排出的烟道气中含氮氧化物(主要为NO、NO2)、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
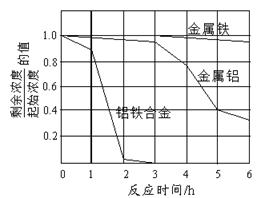
(1)装置A中放置无碱玻璃棉,其目的是除去 ▲ 。为保证检测的准确性,装置C中盛放的化学试剂可以是 ▲ (填字母)。 a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O) (2)装置D中主要发生:2NaOH+2NO2=NaNO2+NaNO3+H2O;2NaOH+NO+NO2=2NaNO2+H2O ①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为 ▲ (填字母)。 a.≥1 b.≤1 c.任意值 ②可使用适量酸性H2O2溶液,将溶液中的 (3)溶液中 步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c( 步骤二、现量取50 mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。 步骤三、重复实验2~3次,溶液中
①金属铝和金属铁在0~3h内, ②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因▲ 。 (4)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理。HClO氧化NO生成
|
|
| 2. | 详细信息 |
|
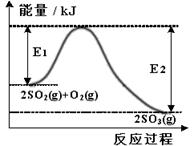
2SO2(g) + O2(g)
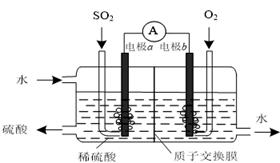
(1)2SO2(g) + O2(g) (2)①下列措施不能使该反应速率加快的是 ▲ 。 A.升高温度 B.降低压强 C.使用催化剂 ②若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是 ▲ 。 A.SO3的浓度不再变化 B.SO2与SO3的物质的量相等 C.容器内气体的压强不再变化 D.单位时间内消耗1 mol O2,同时消耗2 mol SO2 (3)运用电化学原理可生产硫酸,总反应为2SO2 + O2 + 2H2O =2H2SO4,装置如图所示。其中质子交换膜将该原电池分隔成氧化反应室和还原反应室,能阻止气体通过而允许H+通过。
①该电池的负极是 ▲ 。(填“电极a”或“电极b”) ②H+通过质子交换膜时的移动方向是 ▲ 。 A.从左向右 B.从右向左 ③通入O2的电极反应式是 ▲ 。
|
|
| 3. | 详细信息 |
|
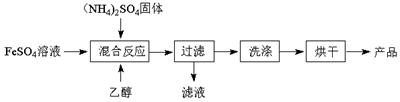
硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O],其相对分子质量为392,在空气中不易被氧化,易溶于水,不溶于乙醇,100℃时易失去结晶水。现用FeSO4溶液与(NH4)2SO4反应,制取硫酸亚铁铵晶体,其流程如图所示:
(1)“混合反应”时温度需控制在70~80℃,可采取的措施是 ▲ ,该过程中乙醇的作用是 ▲ 。 (2)现对制得的硫酸亚铁铵晶体进行纯度测定: 准确称取4.000g上述硫酸亚铁铵晶体置于锥形瓶中溶解,加适量稀硫酸酸化,用0.100 mol·L-1 标准KMnO4溶液进行反应,当MnO 已知: ①若用稀盐酸替代稀硫酸进行酸化,则实际消耗的标准KMnO4溶液的体积 ▲ 20.00 mL。(填“大于”或“小于”或“等于”) ②试通过计算,求该硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]的纯度 (写出计算过程)
|
|
| 4. | 详细信息 |
|
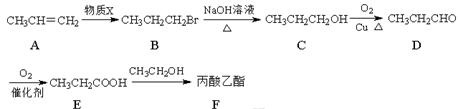
丙酸乙酯常用于合成人造香料,其合成路线如图所示(部分反应条件略去):
(1)化合物B的分子式是 ▲ ,化合物C中含氧官能团的名称为 ▲ 。 (2)E→F的化学反应方程式是 ▲ ,反应类型是 ▲ 。 (3)A→B的反应是加成反应,则物质X的化学式为 ▲ 。 (4)E→F转化中有多种有机副产物,其中一种副产物Q的相对分子质量为74,氢的质量分数为13.51%,分子中碳氢原子个数比是2∶5,则 Q的分子式为 ▲ 。
|
|
| 5. | 详细信息 |
|
短周期主族元素X、Y、Z、W原子序数依次增大,X的单质是空气中含量最高的气体,Y的焰色反应现象为黄色。Z为金属元素,由Z制得的容器常温下可盛装浓硫酸。W原子最外层比X原子最外层多2个电子。 (1)X在元素周期表中的位置为 ▲ ,X单质的结构式为 ▲ 。 (2)W的简单气态氢化物电子式是 ▲ ,该气态氢化物溶于水时,破坏的化学键是 ▲ 。 (3)Y、Z、W的原子半径从大到小的顺序是 ▲ (用元素符号表示)。 Y的最高价氧化物的水化物和Z的最高价氧化物的水化物反应的离子方程式是 ▲ 。
|
|
| 6. | 详细信息 |
|
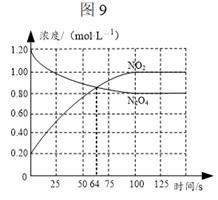
向容积为1.00L的密闭容器中通入一定量的N2O4和NO2的混合气体,发生反应:N2O4(g)
已知:NO2为红棕色气体,N2O4为无色气体 A.64s时,反应达到化学平衡状态 B.到达化学平衡前,混合气体的颜色逐渐变深 C.若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高 D.前100s内,用NO2浓度的变化表示的化学反应速率是
|
|
| 7. | 详细信息 | |||||||||||||||
|
根据下列实验操作和现象所得出的结论正确的是
|
||||||||||||||||
| 8. | 详细信息 |
|
下列装置或操作能达到实验目的的是
A.用图5所示的装置测量NH3的体积 B.用图6所示的装置灼烧Fe(OH)3固体 C.用图7所示的装置验证生石灰与水反应放热 D.用图8所示的装置制取少量乙酸乙酯
|
|
| 9. | 详细信息 |
|
在给定条件下,下列选项所示的物质间转化不能实现的是
|
|
| 10. | 详细信息 |
|
下列离子方程式书写正确的是 A.向铁粉中加入足量稀盐酸:Fe+2H+=Fe3++H2↑ B.向FeCl3溶液中加入少量铜粉: Fe3++ Cu=Fe2+ +Cu2+ C.Cu与稀硝酸反应:3Cu+ 8H++ D.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=
|
|
| 11. | 详细信息 |
|
乳酸具有很强的防腐蚀保鲜功效,其结构简式如图3所示。下列有关乳酸说法不正确的是
A.乳酸分子中含有两种含氧官能团 B.乳酸属于烃类有机物 C.乳酸能发生酯化反应 D.乳酸能和金属钠反应放出氢气
|
|
| 12. | 详细信息 |
|
下列有关浓硝酸说法正确的是 A.保存在无色试剂瓶中 B.易挥发 C.常温时与铁反应放出氢气 D.受热不分解
|
|
| 13. | 详细信息 |
|
下列关于元素周期表叙述不正确的是 A.短周期为第1、2、3周期 B.ⅠA族都是金属元素 C.元素周期表中有7个主族 D.可根据元素在周期表中位置预测其性质
|
|
| 14. | 详细信息 |
|
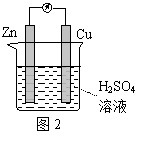
锌铜原电池装置如图2所示,下列说法正确的是
A.Cu是负极 B.反应一段时间后,溶液显蓝色 C.Zn棒发生反应:Zn-2e-=Zn2+ D.该装置实现电能向化学能的转化
|
|
| 15. | 详细信息 |
|
下列有关物质性质与用途具有对应关系的是 A.热的碳酸钠溶液碱性较强,可用于洗涤油污 B.液氨具有还原性,可用作制冷剂 C.石墨具有导电性,可用于制铅笔芯 D.浓硫酸具有强氧化性,可用于干燥H2
|
|
| 16. | 详细信息 |
|
对于可逆反应2SO2+O2 A.使用催化剂能加快反应速率 B.降低温度能加快反应速率 C.增大反应物浓度能减慢反应速率 D.SO2、O2能100%转化为产物
|
|
| 17. | 详细信息 |
|
下列有关苯、乙烯的说法正确的是 A.都易溶于水 B.乙烯在一定条件下可发生加聚反应 C.都能使酸性高锰酸钾溶液褪色 D.苯分子中存在碳碳双键
|
|
| 18. | 详细信息 |
|
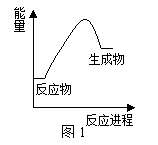
下列关于化学反应与能量的说法正确的是
A.化学键断裂放出能量 B.甲烷燃烧时的能量变化如图1所示 C.铝热反应是放热反应 D.吸热反应均需要加热才能发生
|
|
| 19. | 详细信息 |
|
下列说法正确的是 A.1molN2中含有的分子数为2×6.02×1023 B.电解饱和食盐水可得到金属钠 C.常温下,铝片能溶于浓硝酸 D.常温下,淀粉溶液遇I2变成蓝色
|
|
| 20. | 详细信息 |
|
下列各组离子在水溶液中能大量共存的是 A. C.Mg2+、K+、OH- D.K+、Na+、
|
|
| 21. | 详细信息 |
|
下列各组物质互为同分异构体的是 A.白磷与红磷 B.甲烷与乙烷 C.正丁烷与异丁烷 D.
|
|
| 22. | 详细信息 |
|
下列物质中属于离子化合物的是 A.HCl B.NH3 C.NaOH D.H2
|
|
| 23. | 详细信息 |
|
侯氏制碱法原理:NaCl+ H2O+ CO2+ NH3=NaHCO3↓+ NH4Cl,下列相关化学用语正确的是 A.中子数为8的氮原子:8 7N B.氧原子的结构示意图: C.NaHCO3水中电离:NaHCO3=Na++ H+ + CO2-3 D.CO2的球棍模型:
|
|
| 24. | 详细信息 |
|
“像对待生命一样对待生态环境”。下列做法不应该提倡的是 A.分类放置生活废弃物 B.实现化石燃料清洁利用 C.使用可降解塑料 D.大量使用化肥、农药提高粮食产量
|
|
| 25. | 详细信息 |
|
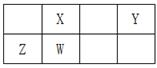
短周期主族元素X、Y、Z、W在周期表中的位置如图所示,其中Y原子的最外层电子数是内层电子数的3倍,下列说法一定正确的是
A.X的简单气态氢化物的热稳定性比W的弱 B.元素Y、Z的简单离子具有相同的电子层结构 C.X与Y只能形成一种化合物 D.W的氧化物形成的晶体是分子晶体
|
|