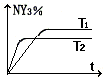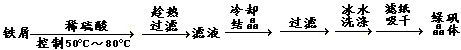山西高三下学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是 ( ) (A)用食醋除去暖水瓶中的薄层水垢 (B)用米汤检验含碘盐中的碘酸钾(KIO3) (C)用食用碱热溶液洗涤餐具上的油污 (D)用灼烧并闻气味的方法区别纯棉织物和纯毛织物
|
|
| 2. | 详细信息 |
|
相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470℃左右,得到KClO4(高锰酸钾)和KCl。下列关于①和②的说法不正确的是 ( ) (A)都是氧化还原反应 (B)发生还原反应的元素相同 (C)发生氧化反应的元素不同 (D)生成KCl的物质的量相同
|
|
| 3. | 详细信息 |
|
甲、乙两元素原子的L层电子数都是其它层电子总数的2倍。下列推断正确的是( ) (A)甲与乙处于同一周期 (B)甲与乙处于同一主族 (C)甲与乙的单质都是原子晶体 (D)甲与乙的原子序数之和为偶数
|
|
| 4. | 详细信息 |
|
下列各组试剂在溶液中反应,当两种试剂的量发生改变时,可用同一离子方程式表示的 ( ) (A)二氧化硫、氢氧化钠 (B)硫酸氢钠、氢氧化钡 (C)氯化铝、氨水 (D)溴化亚铁、氯水
|
|
| 5. | 详细信息 |
|
可用于鉴别以下三种化合物的一组试剂是 ( )
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液 (A)②与③ (B)③与④ (C)①与④ (D)①与②
|
|
| 6. | 详细信息 |
|
下列有关pH变化的判断中,正确的是 ( ) (A)随着温度的升高,NH4Cl和Na2CO3溶液的pH均减小; (B)随着温度的升高,纯水的pH和KW均增大 (C)新氯水制经光照一段时间后,pH减小 (D)氢氧化钠溶液久置于空气中,pH增大
|
|
| 7. | 详细信息 |
|
室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( ) (A)加适量的醋酸钠晶体后,两溶液的pH均增大 (B)使温度都升高20℃后,两溶液的pH均不变 (C)加水稀释2倍后,两溶液的pH均减小 (D)加足量的锌充分反应后,两溶液中产生的氢气一样多
|
|
| 8. | 详细信息 |
|
常见到的标记为Li-ion的电池称为“锂离子电池”。其负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传到Li+的高分子材料。这种锂离子电池的电池反应为:Li+2Li0.35NiO2 下列说法正确的是 ( ) (A)放电时,负极的电极反应式为:LI++e— = Li; (B)充电时,Li发生氧化反应 (C)该电池不能用水溶液作为电解质; (D)放电过程中Li+ 向负极移动
|
|
| 9. | 详细信息 | ||||||||||||
|
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
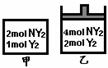
(2)恒容条件下,一定量的NY2、Y2发生反应: 2NY2(g)+Y2(g) NY3的体积分数随时间变化如右图,该反应的△H 0(填 “>”“<”或“=”,下同);若甲乙两容器相同,充入如图
体积不变,乙保持压强不变,反应达平衡时下列分析正确 的是_________ a.乙中NY2转化率大于甲 b.乙中NY3体积分数大于甲; c.乙中 NY3物质的量为甲的2倍 d.甲、乙中NY2转化率相同; (3)X的非金属性比M______(填“强”或“弱”),能证明此结论的事实是_______ (用一离子方程式表示)。
|
|||||||||||||
| 10. | 详细信息 |
|
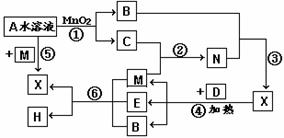
已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为常见金属单质,少量D与足量X的浓溶液在常温下无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)A的结构式 ,E的化学式为 ; (2)在①至⑥的化学反应中,属于氧化还原反应的化合反应为 (填反应序号) (3)写出下列反应的化学方程式② ④
|
|
| 11. | 详细信息 |
|
[Ⅰ] 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验由废铁屑(含Fe2O3)制备FeSO4·7H2O晶体过程如下: (铁屑先用Na2CO3溶液洗涤去除了油污)
(1)铁屑溶解时发生主要反应的离子方程式____________________________ (2)有关制备中的分析错误的是_______ ①铁屑需过量放可除去产生的Fe3+且利于防止产生Fe3+;②趁热过滤目的是加快过滤速度;③硫酸过稀致使溶液浓度过低不利于晶体大量析出;④冰水洗涤能减少晶体的溶解损失;⑤控制温度50)C~80)C利于制成饱和溶液,加速铁屑的溶解; (3)检验滤液中是否含有的Fe3+方法是_____________________________________
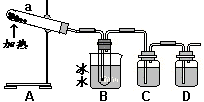
用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和SO2。 (4)① 试管b中得到的主要产物是___________, ② 为检验SO2生成物,试管c中应加入的试剂 是__________ ③ B中所得硫酸的理论浓度(溶质的质量分数)为_________ (5)这一古老的制备方法被淘汰,除原料有限和能耗较高还可能原因有____________
|
|
| 12. | 详细信息 |
|
(1)某芳族化物A由碳、氢、氧三种元素组成,其蒸气密度是相同条件下H2密度的69倍。已知0.1 molA在氧气中完全燃烧得30.8gCO2和0.3mol H2O, 则A的分子式是____________。 A可以与NaHCO3溶液反应、其苯环上有两个邻位的取代基,则A中含氧官能团的名称是 已知: (2)A可以与 (3)已知下列下列信息。分子式为C3H4的烃可以发生下图转化:
其中E、F均呈酸性。F可以与有机物B和乙二醇共同发生反应得到有机物G,由G通过加聚反应可以进一步合成分子式为(C15H15O6)2的药物H。 ①写出F的同分异构体结构简式,且满足a)属于链状酯类、b)分子中每个碳原子上都连有氢原子___________________________________________ ②C→D的化学方程式是_________________________________ ③H的结构简式是_______________________________
|
|