2018й«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹіеўЁзғҜжҳҜдё–дёҠжңҖи–„еҚҙд№ҹжҳҜжңҖеқҡзЎ¬зҡ„жқҗж–ҷпјҢеҸҜз”ЁжқҘз”ҹдә§жңӘжқҘзҡ„и¶…зә§и®Ўз®—жңәгҖӮз»„жҲҗзҹіеўЁзғҜзҡ„е…ғзҙ жҳҜ A. зўі В В В В В В В В В В В В В В B. зЎ… В В В В В В В В В В В C. й“қ В В В В В В В В В В В В В D. й“ң
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ—дә¬2017е№ҙ4жңҲ12ж—Ҙз”ө 12ж—Ҙ19ж—¶04еҲҶпјҢжҲ‘еӣҪеңЁиҘҝжҳҢеҚ«жҳҹеҸ‘е°„дёӯеҝғз”Ёй•ҝеҫҒдёүеҸ·д№ҷиҝҗиҪҪзҒ«з®ӯжҲҗеҠҹеҸ‘е°„е®һи·өеҚҒдёүеҸ·еҚ«жҳҹгҖӮиҝҷжҳҜжҲ‘еӣҪйҰ–йў—й«ҳйҖҡйҮҸйҖҡдҝЎеҚ«жҳҹгҖӮиҜҘзҒ«з®ӯдё»еҸ‘еҠЁжңәдёӯжүҖз”Ёзҡ„ж¶Іж°§пјҲO2пјүеұһдәҺ AпјҺеҚ•иҙЁВ В В В В В В В В В BпјҺж°§еҢ–зү©В В В В В В В В В В CпјҺеҢ–еҗҲзү© В В В DпјҺжңүжңәзү©
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®ӨеҲ¶еҸ–дёӢеҲ—ж°”дҪ“еҸҜд»Ҙз”ЁжҺ’ж°ҙ法收йӣҶзҡ„жҳҜ A. NH3В В В В В В В В В В В В В B. NO2В В В В В В В В В В C. NOВ В В В В В В В В В В В В В D. SO2
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
В еңЁз”ҹдә§з”ҹжҙ»дёӯпјҢдёӢеҲ—дёҚеұһдәҺеҢ–еӯҰеҸҳеҢ–зҡ„жҳҜ A. з”Ёй“ҒзҹҝзҹіеҶ¶зӮјй“ҒВ В В В В В В В В В В В В В В В В В B. з”Ёй“қзғӯеҸҚеә”з„ҠжҺҘй“ҒиҪЁ C. з”ЁзҹіжІ№еҲҶйҰҸеҫ—жұҪжІ№ В В В В В В В В В В В В В В В В D. ж°Ҝзўұе·ҘдёҡеҲ¶ж°ўж°§еҢ–й’
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҺЁжҲҝдёӯеёёи§Ғзү©иҙЁпјҢжә¶дәҺж°ҙд№ӢеҗҺеҪўжҲҗзҡ„жә¶ж¶ІиғҪдә§з”ҹвҖңдёҒиҫҫе°”вҖқж•Ҳеә”зҡ„жҳҜ AпјҺйЈҹйҶӢВ В В В В В В В В В BпјҺйЈҹзӣҗВ В В В В В В В В CпјҺж·ҖзІүВ В В В В В В В В В DпјҺзҷҪзі–
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҢ–еӯҰз”ЁиҜӯиЎЁзӨәжӯЈзЎ®зҡ„жҳҜ AпјҺNa2Oзҡ„з”өеӯҗејҸпјҡ BпјҺж°§еҺҹеӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ CпјҺзўій…ёж°ўй’ жә¶дәҺж°ҙзҡ„з”өзҰ»ж–№зЁӢејҸпјҡ NaHCO3 пјқ Na+ + H+ + CO32пјҚВ В DпјҺд№ҷйҶҮзҡ„еҲҶеӯҗејҸпјҡC2H5OH
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
14CжҳҜдёҖз§Қж”ҫе°„жҖ§еҗҢдҪҚзҙ пјҢеңЁй«ҳеұӮеӨ§ж°”дёӯз”ұе®Үе®ҷе°„зәҝдә§з”ҹзҡ„дёӯеӯҗжҲ–ж ёзҲҶзӮёдә§з”ҹзҡ„дёӯеӯҗиҪ°еҮ»14NеҸҜдҪҝе®ғиҪ¬еҸҳдёә14CгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺ14Cе’Ң14Nдә’дёәеҗҢдҪҚзҙ В В В В В В В В В В В В В В В В BпјҺ14Cе’ҢC60жҳҜеҗҢеҲҶејӮжһ„дҪ“ CпјҺ146Cж ёзҙ зҡ„дёӯеӯҗж•°дёә8В В В В В В В В В В В В В В В В DпјҺ14Nж ёзҙ зҡ„иҙЁеӯҗж•°дёә14
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯпјҢеҸӘеҗ«зҰ»еӯҗй”®иҖҢдёҚеҗ«е…ұд»·й”®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В AпјҺВ Na2O2В В В В В В В В В В В В В BпјҺCaCl2В В В В В В В В В В В В В В В CпјҺNeВ В В В В В В В В В В DпјҺCCl4
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®Өз”ЁеӨ§зҗҶзҹіе’Ңзӣҗй…ёеҸҚеә”еҲ¶еҸ–CO2гҖӮдёӢеҲ—жҺӘж–ҪеҸҜдҪҝеҸҚеә”йҖҹзҺҮеҠ еҝ«зҡ„жҳҜ AпјҺйҷҚдҪҺеҸҚеә”жё©еәҰВ В В В В BпјҺ延й•ҝеҸҚеә”ж—¶й—ҙВ В CпјҺзІүзўҺеӨ§зҗҶзҹіВ В В DпјҺеҠ ж°ҙзЁҖйҮҠзӣҗй…ё
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
иӢҜжҳҜйҮҚиҰҒзҡ„жңүжңәеҢ–е·ҘеҺҹж–ҷгҖӮдёӢеҲ—е…ідәҺиӢҜзҡ„жҖ§иҙЁиҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺеёёжё©еёёеҺӢдёӢдёәж°”дҪ“В В В В В В В В В В В В BпјҺиғҪеҸ‘з”ҹеҸ–д»ЈеҸҚеә”В В В CпјҺиӢҜзҡ„з»“жһ„жҳҜеҚ•еҸҢй”®дәӨжӣҝ В В В В В В В В DпјҺжҳ“жә¶дәҺж°ҙ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ | |||
|
д»Һжө·еёҰдёӯжҸҗеҸ–зўҳеә”иҜҘеҢ…жӢ¬зҒјзғ§гҖҒжә¶и§ЈгҖҒиҝҮж»ӨгҖҒж°§еҢ–гҖҒиҗғеҸ–гҖҒи’ёйҰҸзӯүиҝҮзЁӢгҖӮдёӢеҲ—жңүе…іеӣҫзӨәж“ҚдҪңжӯЈзЎ®зҡ„жҳҜ
AпјҺз”ЁиЈ…зҪ®з”Іе°Ҷе№Іжө·еёҰзҒјзғ§жҲҗзҒ°В В В BпјҺз”ЁиЈ…зҪ®д№ҷиҝҮж»Өеҫ—еҗ«I- зҡ„жә¶ж¶І CпјҺз”ЁиЈ…зҪ®дёҷеҲҶзҰ»еҮәзўҳзҡ„CCl4жә¶ж¶І DпјҺз”ЁиЈ…зҪ®дёҒи’ёйҰҸиҺ·еҫ—зўҳ并еӣһ收CCl4
|
||||
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ізү©иҙЁжҖ§иҙЁе’Ңз”ЁйҖ”е…·жңүеҜ№еә”е…ізі»зҡ„жҳҜ AпјҺдәҢж°§еҢ–зЎ…зҶ”зӮ№й«ҳпјҢжүҖд»Ҙз”ЁдәҺеҲ¶е…үеҜјзәӨз»ҙ BпјҺжө“зЎ«й…ёе…·жңүи„ұж°ҙжҖ§пјҢеҸҜз”ЁдәҺе№ІзҮҘж°”дҪ“ CпјҺCa(ClO)2е…·жңүејәж°§еҢ–жҖ§пјҢеҸҜз”ЁдәҺж¶ҲжҜ’жқҖиҸҢе’ҢжјӮзҷҪВ В DпјҺз”ІйҶӣеҸҜд»ҘдҪҝиӣӢзҷҪиҙЁеҸҳжҖ§пјҢеёёз”ЁжқҘйЈҹе“ҒдҝқйІң
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁејәй…ёжҖ§жә¶ж¶ІдёӯпјҢдёӢеҲ—зҰ»еӯҗз»„иғҪеӨ§йҮҸе…ұеӯҳдё”жә¶ж¶Ідёәж— иүІйҖҸжҳҺзҡ„жҳҜВ AпјҺNaпјӢгҖҒKпјӢгҖҒOHпјҚгҖҒClпјҚ В В В В В В В В В В В В В В В BпјҺNaпјӢгҖҒCu2пјӢгҖҒSO32пјҚгҖҒNO3пјҚ CпјҺMg2пјӢгҖҒNaпјӢгҖҒSO42пјҚгҖҒClпјҚ В В В В В В В В В В В В DпјҺBa2пјӢгҖҒHCO3пјҚгҖҒNO3пјҚгҖҒKпјӢ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҢҮе®ҡеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ AпјҺж°ҜеҢ–й“Ғжә¶ж¶ІдёҺй“ңеҸҚеә”пјҡ2Fe3пјӢпјӢCu===2Fe2пјӢпјӢCu2пјӢ BпјҺAlжә¶дәҺNaOHжә¶ж¶Іпјҡ2AlпјӢ2OHпјҚпјқ2AlO CпјҺй“ңдёҺзЁҖзЎқй…ёеҸҚеә” пјҡ Cu + 8H+ + 2NO3Лү= Cu2+ + 2NOвҶ‘ + 4H2O DпјҺеҗ‘Ba(OH)2жә¶ж¶ІдёӯеҠ и¶ійҮҸзЁҖH2SO4пјҡBa2+пјӢOH-пјӢH+пјӢSO42-пјқBaSO4вҶ“пјӢH2O
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҝҮзЁӢйңҖиҰҒеҗёж”¶зғӯйҮҸзҡ„жҳҜ AпјҺжұҪжІ№зҮғзғ§В В В В В В В В В В В BпјҺй“қзғӯеҸҚеә”В В В В В В В В CпјҺж¶Іж°Ёзҡ„ж°”еҢ–В В В В В В В В В DпјҺж°§еҢ–й’ҷе’Ңж°ҙеҸҚеә”
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёәзЎ®и®Өзўій…ёж°ўй’ еӣәдҪ“дёӯжҳҜеҗҰеҗ«жңүзўій…ёй’ пјҢдёӢеҲ—е®һйӘҢж“ҚдҪңеҸҠеҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ A. еҠ зғӯпјҢи§ӮеҜҹжҳҜеҗҰж”ҫеҮәж°”дҪ“В В В В В В В B. ж»ҙеҠ зӣҗй…ёпјҢи§ӮеҜҹжҳҜеҗҰж”ҫеҮәж°”дҪ“ C. жә¶дәҺж°ҙдёӯпјҢж»ҙеҠ жҫ„жё…зҹізҒ°ж°ҙпјҢи§ӮеҜҹжҳҜеҗҰжңүзҷҪиүІжІүж·Җз”ҹжҲҗ D. жә¶дәҺж°ҙдёӯпјҢж»ҙеҠ е°‘йҮҸж°ҜеҢ–й’Ўжә¶ж¶ІпјҢи§ӮеҜҹжҳҜеҗҰжңүзҷҪиүІжІүж·Җз”ҹжҲҗ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”дёӯпјҢеұһдәҺеҠ жҲҗеҸҚеә”зҡ„жҳҜ A. CH2===CH2пјӢH2O BпјҺCH2===CHCH3пјӢCl2
D. CH3COOHпјӢCH3CH2OHВ В В В В В В В В CH3COOCH2CH3пјӢH2O
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
В е·ҘдёҡдёҠз”ҹдә§ж°®еҢ–зЎ…йҷ¶з“·еҸҚеә”дёә3SiCl4пјӢ2N2пјӢ6H2 A. SiCl4жҳҜж°§еҢ–еүӮВ В В В В В В В В В В В В В В B. N2еӨұз”өеӯҗВ В В C. H2иў«иҝҳеҺҹ В В В В В В В В В В В В В В В В В В В В D. N2еҸ‘з”ҹиҝҳеҺҹеҸҚеә”
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ AпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ1 molд№ҷйҶҮзҡ„дҪ“з§ҜзәҰдёә22.4L BпјҺ32g O2е’Ң O3зҡ„ж··еҗҲзү©дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°дёә2 NA CпјҺ1 mol FeдёҺи¶ійҮҸзЁҖзӣҗй…ёеҸҚеә”иҪ¬з§»зҡ„з”өеӯҗж•°дёә3 NA DпјҺ1 molВ·LпјҚ1 Na2CO3жә¶ж¶Ідёӯеҗ«жңүзҡ„й’ зҰ»еӯҗж•°дёә2 NA
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢж–№жі•иғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜ AпјҺжҹҗж— иүІжә¶ж¶ІдёӯеҠ зўій…ёй’ жә¶ж¶Ідә§з”ҹзҷҪиүІжІүж·ҖпјҢиҜҒжҳҺеҺҹжә¶ж¶Ідёӯеҗ«жңүCa2+ BпјҺй“ӮдёқиҳёеҸ–жҹҗжңӘзҹҘжә¶ж¶ІдәҺй…’зІҫзҒҜзҒ«з„°дёҠзҒјзғ§пјҢжҳҫй»„иүІпјҢиҜҒжҳҺиҜҘжә¶ж¶ІдёӯдёҚеҗ«KпјӢ CпјҺеҗ‘жҹҗжңӘзҹҘжә¶ж¶Ідёӯе…ҲеҠ ж°Ҝж°ҙпјҢеҶҚж»ҙеҠ KSCNжә¶ж¶ІеҮәзҺ°иЎҖзәўиүІпјҢиҜҒжҳҺжә¶ж¶Ідёӯеҗ«жңүFe2пјӢ DпјҺеҗ‘жҹҗж— иүІжә¶ж¶Ідёӯе…ҲеҠ е…Ҙзӣҗй…ёй…ёеҢ–пјҢж— зҺ°иұЎпјҢеҶҚеҠ е…Ҙж°ҜеҢ–й’Ўжә¶ж¶ІпјҢз”ҹжҲҗзҷҪиүІжІүж·ҖпјҢиҜҙжҳҺеҺҹжә¶ж¶ІдёӯжңүSO42-
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
й”Ң-з©әж°”з”өжұ пјҲеҸіеӣҫпјүйҖӮе®ңз”ЁдҪңеҹҺеёӮз”өеҠЁиҪҰзҡ„еҠЁеҠӣ
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺж°§ж°”еңЁзҹіеўЁз”өжһҒдёҠеҸ‘з”ҹж°§еҢ–еҸҚеә” BпјҺз”өеӯҗд»ҺзҹіеўЁз”өжһҒйЎәзқҖеҜјзәҝжөҒеҗ‘Znз”өжһҒ CпјҺиҜҘз”өжұ ж”ҫз”өж—¶жә¶ж¶Ідёӯзҡ„OH- еҗ‘Znз”өжһҒ移еҠЁ DпјҺз”өжұ ж”ҫз”өж—¶з”өиғҪиҪ¬еҸҳдёәеҢ–еӯҰиғҪ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒWеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢXеҺҹеӯҗзҡ„ж ёеӨ–жңү7дёӘз”өеӯҗпјҢеңЁе‘ЁжңҹиЎЁдёӯYдҪҚдәҺв…ЎAж—ҸпјҢYгҖҒZеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’ҢзӯүдәҺWеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°пјҢWзҡ„ж°ўеҢ–зү©зғӯзЁіе®ҡжҖ§еңЁеҗҢе‘Ёжңҹе…ғзҙ дёӯжңҖејәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺеҺҹеӯҗеҚҠеҫ„пјҡr(X)<r(Y)<r(Z)<r(W) BпјҺе…ғзҙ YгҖҒWзҡ„з®ҖеҚ•зҰ»еӯҗе…·жңүзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„ CпјҺZзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§жҜ”Xзҡ„ејә DпјҺз”ұWдёҺYдёӨз§Қе…ғзҙ з»„жҲҗзҡ„з®ҖеҚ•еҢ–еҗҲзү©жҳҜзҰ»еӯҗеҢ–еҗҲзү©
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
жңүдёҖеҢ…й“ҒзІүе’Ңй“ңзІүж··еҗҲеқҮеҢҖзҡ„зІүжң«ж ·е“ҒпјҢдёәзЎ®е®ҡе…¶з»„жҲҗпјҢжҹҗеҗҢеӯҰе°ҶдёҚеҗҢиҙЁйҮҸзҡ„иҜҘж ·е“ҒеҲҶеҲ«дёҺ40 mLпјҢ1 mol/Lзҡ„FeCl3жә¶ж¶ІеҸҚеә”пјҢе®һйӘҢз»“жһңеҰӮдёӢиЎЁжүҖзӨә(еҝҪз•ҘеҸҚеә”еүҚеҗҺжә¶ж¶ІдҪ“з§Ҝзҡ„еҫ®е°ҸеҸҳеҢ–)гҖӮ
дёӢеҲ—е®һйӘҢз»“и®әдёҚжӯЈзЎ®зҡ„жҳҜ AпјҺеҺҹзІүжң«ж ·е“Ғдёӯm(Fe)вҲ¶m(Cu)пјқ7вҲ¶8 BпјҺе®һйӘҢв‘ еҸҚеә”еҗҺжә¶ж¶Ідёӯеҗ«жңүFe3пјӢгҖҒFe2пјӢгҖҒCu2пјӢ CпјҺе®һйӘҢв‘ЎгҖҒв‘ўеҸҚеә”еҗҺзҡ„еү©дҪҷеӣәдҪ“е…ЁйғЁжҳҜCu DпјҺе®һйӘҢв‘Јзҡ„ж»Өж¶Ідёӯc(Fe2пјӢ)пјқ1.5 mol/L
|
||||||||||||||||
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
в‘ҙпјҲ4еҲҶпјүдҝғиҝӣз”ҹжҖҒж–ҮжҳҺпјҢдҝқжҠӨз”ҹжҖҒзҺҜеўғпјҢжҳҜе®һзҺ°вҖңдёӯеӣҪжўҰвҖқзҡ„йҮҚиҰҒз»„жҲҗйғЁеҲҶгҖӮ в‘ В В В В з”ҹжҙ»дёӯдёҖж¬ЎжҖ§зү©е“Ғзҡ„дҪҝз”ЁдјҡеӨ§еӨ§еўһеҠ з”ҹжҖҒеҺӢеҠӣпјҢдёҖж¬ЎжҖ§зәёе·ҫдҪҝз”ЁеҗҺеә”жҠ•е…Ҙиҙҙжңү В В В В В В В В пјҲеЎ«еӯ—жҜҚпјүж Үеҝ—зҡ„еһғеңҫжЎ¶еҶ…гҖӮ
aВ В В В В В В В В В В В В В В В В В В bВ В В В В В В В В В В В В В В В c в‘Ў з”ЁжҳҺзҹҫеӨ„зҗҶеәҹж°ҙдёӯз»Ҷе°ҸжӮ¬жө®йў—зІ’зҡ„ж–№жі•еұһдәҺВ В В В В В В В пјҲеЎ«еӯ—жҜҚпјүгҖӮ aпјҺж··еҮқжі•В В В В В В В В bпјҺдёӯе’Ңжі•В В В В В В В В В cпјҺж°§еҢ–иҝҳеҺҹжі•
в‘өпјҲ5еҲҶпјүиҗҘе…»е№іиЎЎгҖҒ科еӯҰдҪҝз”ЁйЈҹе“Ғж·»еҠ еүӮжңүеҠ©дәҺеҒҘеә·е’ҢжҸҗй«ҳе…Қз–«еҠӣгҖӮ
в‘Ў жҹҗе“ҒзүҢй«ҳй’ҷжўіжү“зҡ„й…Қж–ҷж ҮзӯҫеҰӮеҸіеӣҫжүҖзӨәгҖӮ еңЁжүҖеҲ—й…Қж–ҷдёӯпјҢеҜҢеҗ«зі–зұ»зҡ„жҳҜВ В В В В В В В В В В В В пјҢ жӨҚзү©жІ№еңЁдҪ“еҶ…ж°ҙи§ЈжңҖз»Ҳдә§зү©жҳҜй«ҳзә§и„ӮиӮӘй…ёе’ҢВ В В В В В В гҖӮ зўій…ёй’ҷдёҺиғғй…ёеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В гҖӮ ⑶пјҲ6еҲҶпјүжқҗж–ҷзҡ„дёҚж–ӯеҸ‘еұ•еҸҜд»ҘдҝғиҝӣзӨҫдјҡиҝӣжӯҘгҖӮ в‘ з”ҹдә§зҺ»з’ғж—¶пјҢзәҜзўұдёҺзҹіиӢұеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮзўіеҢ–зЎ…зЎ¬еәҰеҫҲеӨ§пјҢе®ғеұһдәҺВ В В В В В В В В В пјҲеЎ«еӯ—жҜҚпјүгҖӮ aпјҺйҮ‘еұһжқҗж–ҷВ В В В В В bпјҺж— жңәйқһйҮ‘еұһжқҗж–ҷВ В В В В В В В cпјҺжңүжңәй«ҳеҲҶеӯҗжқҗж–ҷ в‘Ў з”ЁдәҺеҢ…иЈ…йЈҹе“Ғзҡ„еЎ‘ж–ҷиўӢпјҢеә”йҖүз”ЁВ В В В В В В В В В В В В В В В пјҲеЎ«вҖңиҒҡд№ҷзғҜеЎ‘ж–ҷвҖқжҲ–вҖңиҒҡж°Ҝд№ҷзғҜеЎ‘ж–ҷвҖқпјүпјҢеҗҲжҲҗиҜҘеЎ‘ж–ҷзҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
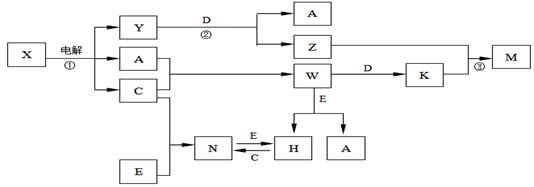
AгҖҒCгҖҒDгҖҒEжҳҜдёӯеӯҰеҢ–еӯҰеёёи§Ғзҡ„еҚ•иҙЁпјҢ YгҖҒZгҖҒMгҖҒNгҖҒWгҖҒHгҖҒKжҳҜеёёи§Ғзҡ„еҢ–еҗҲзү©пјҢDгҖҒEдёәеёёи§ҒйҮ‘еұһпјҢXжҳҜжө·ж°ҙзҡ„дё»иҰҒжҲҗеҲҶпјҢMжҳҜдёҖз§Қйҡҫжә¶дәҺж°ҙзҡ„зҷҪиүІжІүж·ҖгҖӮпјҲеҸҚеә”зү©е’Ңдә§зү©дёӯзҡ„H2Oе·Із•ҘеҺ»пјүпјҡ
пјҲ1пјүHзҡ„еҢ–еӯҰејҸпјҡВ В В В В В В В В В В В В В В гҖӮ пјҲ2пјүWзҡ„з”өеӯҗејҸдёәпјҡВ В В В В В В В В В В В В гҖӮ пјҲ3пјүеҸҚеә”в‘ зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүеҸҚеә”в‘ўзҡ„зҰ»еӯҗж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
иҝҮж°§еҢ–й’ҷжҷ¶дҪ“пјҲCaO2В·8H2Oпјүе‘ҲзҷҪиүІпјҢеҫ®жә¶дәҺж°ҙпјҢеҠ зғӯиҮі350в„ғе·ҰеҸіејҖе§ӢеҲҶи§Јж”ҫеҮәж°§ж°”гҖӮиҝҮж°§еҢ–й’ҷеҸҜз”ЁдәҺж”№е–„ең°иЎЁж°ҙиҙЁгҖҒеӨ„зҗҶеҗ«йҮҚйҮ‘еұһзІ’еӯҗеәҹж°ҙгҖҒеә”жҖҘдҫӣж°§зӯүгҖӮе®һйӘҢе®ӨеҸҜз”Ёе·Ҙдёҡзўій…ёй’ҷпјҲеҗ«MgCO3гҖҒFeCO3зӯүжқӮиҙЁпјүеҲ¶еҸ–зәҜеҮҖзҡ„зўій…ёй’ҷпјҢ然еҗҺеҶҚз”ЁзәҜзҡ„зўій…ёй’ҷеҲ¶еҸ–иҝҮж°§еҢ–й’ҷпјҢе…¶дё»иҰҒжөҒзЁӢеҰӮдёӢпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҸҚеә”в‘ дёӯеҠ е…Ҙзҡ„зЁҖзЎқй…ёе’ҢFeCO3еҸ‘з”ҹдәҶж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢеҶҷеҮәеҢ–еӯҰж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүеҸҚеә”в‘ЎиҰҒз”ЁвҖңеҶ°ж°ҙеҶ·еҚҙвҖқзҡ„дё»иҰҒеҺҹеӣ жҳҜпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүжЈҖйӘҢCaO2В·8H2Oжҷ¶дҪ“жҳҜеҗҰжҙ—ж¶Өе№ІеҮҖзҡ„ж–№жі•пјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүж°ҙдёӯжә¶и§Јж°§зҡ„жөӢе®ҡж–№жі•еҰӮдёӢпјҡеҗ‘дёҖе®ҡйҮҸж°ҙж ·дёӯеҠ е…ҘйҖӮйҮҸMnSO4е’ҢзўұжҖ§KIжә¶ж¶ІпјҢз”ҹжҲҗMnO(OH)2жІүж·ҖпјҢеҜҶе°ҒйқҷзҪ®пјӣеҠ е…ҘйҖӮйҮҸзЁҖH2SO4пјҢеҫ…MnO(OH)2дёҺIпјҚе®Ңе…ЁеҸҚеә”з”ҹжҲҗMn2+е’ҢI2еҗҺпјҢд»Ҙж·ҖзІүдҪңжҢҮзӨәеүӮпјҢз”ЁNa2S2O3ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡиҮіз»ҲзӮ№пјҢжөӢе®ҡиҝҮзЁӢдёӯзү©иҙЁзҡ„иҪ¬еҢ–е…ізі»еҰӮдёӢпјҡВ е·ІзҹҘпјҡI2 + 2S2O32вҲ’ = 2IвҲ’ + S4O62вҲ’ в‘ еҶҷеҮәзўұжҖ§зҺҜеўғдёӢO2е°ҶMn2+ ж°§еҢ–жҲҗMnO(OH)2жІүж·Җзҡ„зҰ»еӯҗж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В гҖӮ в‘ЎВ В В В еҸ–еҠ иҝҮдёҖе®ҡйҮҸCaO2в–Ә8H2Oзҡ„жұ еЎҳж°ҙж ·100.00 mLпјҢжҢүдёҠиҝ°ж–№жі•жөӢе®ҡж°ҙдёӯжә¶и§ЈO2йҮҸпјҢж¶ҲиҖ—0.01000 molв–ӘLвҲ’1 зҡ„Na2S2O3ж ҮеҮҶжә¶ж¶І13.50 mLгҖӮи®Ўз®—иҜҘж°ҙж ·дёӯзҡ„жә¶и§Јж°§(з”Ёmgв–ӘLвҲ’1иЎЁзӨә)пјҹпјҲжіЁж„Ҹпјҡеҝ…йЎ»еҶҷеҮәи®Ўз®—иҝҮзЁӢгҖӮпјү
|
|
- 2018е№ҙиҮі2019е№ҙй«ҳдёҖдёҠеҶҢ第дёҖж¬ЎиҙЁйҮҸжЈҖжҹҘеҢ–еӯҰиҖғйўҳпјҲжІіеҚ—зңҒжөҺжәҗеёӮ第еӣӣдёӯеӯҰпјү
- еҝ…дҝ®з¬¬дәҢеҶҢ 第2з« еҢ–еӯҰй”® еҢ–еӯҰеҸҚеә”规еҫӢ 第2иҠӮ еҢ–еӯҰеҸҚеә”дёҺиғҪйҮҸиҪ¬еҢ– 第2иҜҫж—¶ еҢ–еӯҰеҸҚеә”иғҪйҮҸиҪ¬еҢ–зҡ„йҮҚиҰҒеә”з”Ё
- зҰҸе»әзңҒзҰҸе·һеёӮ第дёүдёӯеӯҰ2021еұҠй«ҳдёүеҗҺеҚҠжңҹ第八次иҙЁйҮҸжЈҖжөӢеҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- 2019пјҲдё“йўҳ8 第дёҖеҚ•е…ғ 第1иҜҫж—¶ еӨ©з„¶ж°”еҲ©з”Ё з”Ізғ·-й«ҳдёӯеҢ–еӯҰеҝ…дҝ®з¬¬дәҢеҶҢиӢҸж•ҷзүҲпјү
- еҢ—дә¬еёӮ第еӣӣдёӯеӯҰ2020еұҠй«ҳдёүдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғйўҳеҗҢжӯҘи®ӯз»ғ
- жұҹиҘҝзңҒй«ҳе®үдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- еұұдёңзңҒйқ’еІӣ第дәҢдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠжңҹ12жңҲжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- еҗҙеҝ еёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢеҚ•е…ғжөӢиҜ•ж‘ёеә•иҖғиҜ•йўҳ


 В В В В В В В В В
В В В В В В В В В  В В В В В В В В
В В В В В В В В  В В
В В