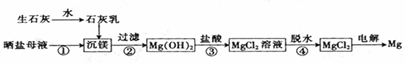2019甘肃高三上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
化学与生活、社会密切相关,下列说法正确的是( ) A. SO2可以用来漂白纸浆、毛、丝、草帽辫等,但不能用做食品添加剂 B. 通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2 C. 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 D. FeCl3溶液能与Cu反应,可用于刻蚀印刷电路
|
|
| 2. | 详细信息 |
|
用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是( ) A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却 B. 必需的定量仪器有100 mL量筒、250 mL容量瓶和托盘天平 C. 量取浓硫酸的体积为25.0 mL D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
|
|
| 3. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.1 mol O2与金属钠反应,O2一定得到4NA个电子 B.18 g NH4+中所含的电子数为10NA C. 1 mol Fe与足量的Cl2反应,转移2NA个电子 D.标准状况下,22.4 L SO2和22.4 L SO3中所含分子数均为NA
|
|
| 4. | 详细信息 |
|
下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( ) ①Al2O3; ②Ca(OH)2; ③SiO2; ④Al; ⑤NaHCO3; ⑥(NH4)2CO3 A. ①②⑤ B. ③④⑤⑥ C. ①④⑤⑥ D. ①②③④⑤⑥
|
|
| 5. | 详细信息 |
|
下列各组物质相互混合反应后,最终有白色沉淀生成的是( ) ①金属钠投入FeCl3溶液中; ②过量NaOH溶液和明矾溶液混合; ③少量Ca(OH)2投入过量NaHCO3溶液中; ④向AlCl3溶液中滴入NaHCO3溶液; ⑤向饱和Na2CO3溶液中通入足量CO2 A. ①③④⑤ B. 只有①④ C. 只有②③ D. 只有③④⑤
|
|
| 6. | 详细信息 |
|
铝和铍及其化合物的性质十分相似。下列关于铍的性质推断正确的是( ) A. 铍能与强酸或强碱溶液发生反应 B. 氢氧化铍可溶于水 C. 氯化铍溶液呈中性 D. 氧化铍的化学式为Be2O3
|
|
| 7. | 详细信息 |
|
下列关于Si、Cl、S等非金属元素单质及其化合物的说法正确的是( ) A. 实验室可用浓硫酸干燥硫化氢 B. 陶瓷、水晶、水泥、玻璃都属于硅酸盐产品 C. 漂白粉变质后的残留固体有碳酸钙 D. 单质氯气及单质硫与铜反应生成的产物中,铜的化合价相同
|
|
| 8. | 详细信息 |
|
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3.分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的是( ) A.
|
|
| 9. | 详细信息 |
|
下列离子方程式正确的是( ) A.硅与氢氟酸的反应:Si+4H++4F-===SiF4↑+2H2↑ B.向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO C.向苯酚溶液中滴加Na2CO3溶液: D.向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++ NO
|
|
| 10. | 详细信息 |
|
下列除去杂质的方法不正确的是( ) A. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 B. 用过量氨水除去Fe3+溶液中的少量Al3+ C. 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 D. 铜中混有铁粉:加过量硫酸铜溶液后过滤
|
|
| 11. | 详细信息 |
|
A. 洗气瓶中产生的沉淀是BaCO3 B. Z导管出来的气体中无CO2 C. 洗气瓶中产生的沉淀只有BaSO4 D. 洗气瓶中产生的沉淀可能有BaSO3
|
|
| 12. | 详细信息 |
|
有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是( ) A. 加硝酸后的不溶性沉淀一定是BaSO4 B. Na2SO3已部分被空气中的氧气氧化 C. 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 D. 此实验能确定Na2SO3是否被部分氧化
|
|
| 13. | 详细信息 | |||||||||||||||
|
下列实验中,对应的实验现象和实验结论都正确且具有因果关系的是( )
|
||||||||||||||||
| 14. | 详细信息 |
|
我国成功地发射了嫦娥一号探测卫星,对月球土壤中14种元素的分布及含量进行探测等。月球的矿产资源极为丰富,仅月球表层 5 cm 厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石(CaMgSi2O6)、斜长石(NaAlSi3O8)和橄榄石[(Mg或Fe)2SiO4]等。下列说法或分析不正确的是( ) A. 辉石、斜长石及橄榄石均属于硅酸盐矿 B. 斜长石的氧化物形式可表示为Na2O·Al2O3·3SiO2 C. 月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 D. 橄榄石中铁元素为+2价
|
|
| 15. | 详细信息 |
|
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀Cu1,溶液变为棕色。再向反应后的混合物中不断通过SO2气体,溶液逐渐变成无色。下列分析正确的是( ) A. 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 B. 通入SO2时,SO2与I2反应,I2作还原剂 C. 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 D. 滴加KI溶液时,转移2moIe-时生成Imo1白色沉淀
|
|
| 16. | 详细信息 |
|
已知NH3和HCl都是能用来做喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行如图所示实验(两烧瓶内充满溶液且不考虑溶质的扩散)。下列说法错误的是( )
B. 制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸 C. 若烧瓶中改为NO2,则所得溶液溶质的物质的量浓度与前两者不同 D. 去掉装置中的胶头滴管,改为单孔塞,也可引发喷泉
|
|
| 17. | 详细信息 |
|
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
|
|
| 18. | 详细信息 |
|
在混合体系中确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( ) A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2: I-、Br-、Fe2+ B.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn: Fe3+、Cu2+、H+、Fe2+ C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2: KOH、Ba(OH)2、BaCO3、K2CO3 D.在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
|
|
| 19. | 详细信息 |
|
氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。下列有关反应的化学方程式不正确的是( ) A. (CN)2+H2=2HCN B. MnO2+4HCN=Mn(CN)2+(CN)2↑+2H2O C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2 D. 在NaBr和KCN混合液中通入少量Cl2:Cl2+2KCN=2KCl+(CN)2
|
|
| 20. | 详细信息 |
|
铝土矿的主要成分为Al2O3、Fe2O3和SiO2,工业上经过如图所示工艺可以冶炼金属铝。下列说法中不正确的是( )
A. ①②中除加试剂外,还需要进行过滤操作 B. a、b中铝元素的化合价相同 C. ④进行的操作是过滤、加热,而且d一定是氧化铝 D. ③中需要通入过量的氨气
|
|
| 21. | 详细信息 |
|
用海水制盐工业中的母液来生产金属镁的一种工艺流程如下下列说法错误的是( )
A. 上述工艺流程中未涉及置换反应 B. 设计步骤①、②、③的主要目的是富集MgCl2 C. 脱水时在HCl气氛中进行可抑制MgCl2水解 D. 电解得到的炽热镁粉可在氮气中冷却
|
|
| 22. | 详细信息 |
|
为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应的化学方程式:2NO2+2NaOH===NaNO2+H2O+NaNO3、NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液中溶质的物质的量浓度为(mol·L-1)( ) A.
|
|
| 23. | 详细信息 |
|
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是2 mol·L-1和4 mol·L-1,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO)( ) A. 0.448 L B. 0.672 L C. 0.896 L D. 0.224 L
|
|
| 24. | 详细信息 |
|
1.76g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2气体1792mL(标准状况),向反应后的溶液中加入适量的1.0 mol·L-1NaOH溶液,恰好使溶液中的金属离子全部沉淀。下列说法不正确的是( ) A. 该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1 B. 浓硝酸在反应中表现了氧化性和酸性,且表现氧化性的硝酸的物质的量为0.08 mol C. 得到沉淀的质量为3.12g D. 加入NaOH溶液的体积是50 mL
|
|
| 25. | 详细信息 |
|
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下反应关系:
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。写出反应④的化学方程式: 。 (2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式: 。 (3) 若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素位于同一主族,且溶液均显碱性。写出反应②的化学方程式: 。 (4) 若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式: 。 (5)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式: 。
|
|
| 26. | 详细信息 |
|
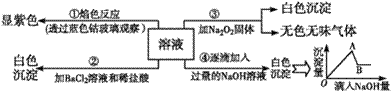
有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分取此溶液分别进行了四个实验,其操作和有关现象如图所示:
请你根据上图推断: (1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。 (2)实验③中产生无色无味气体所发生的化学方程式为________________________________。 (3)写出实验④中A点对应沉淀的化学式:__________。 (4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
|
|
| 27. | 详细信息 |
|
高铁酸钾(K2FeO4)是一种集强氧化性、吸附、絮凝于一体的新型多功能处理剂,其生产工艺如图所示:
已知K2FeO4具有下列性质: ①可溶于水、微溶于浓KOH溶液 ②在0~5 ℃、强碱性溶液中比较稳定 ③在Fe3+和Fe(OH)3催化作用下发生分解 ④在酸性至碱性条件下,能与水反应生成Fe(OH)3和O2 请完成下列填空: (1)已知Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,生产KClO应在温度 的情况下进行(填“较高”或“较低”)。 (2)生产K2FeO4的反应原理是: Fe(NO3)3+KClO+KOH—→K2FeO4+KNO3+KCl+H2O(未配平) 则该反应中氧化剂与还原剂的物质的量之比为 。 (3)K2FeO4在弱碱性条件下能与水反应生成Fe(OH)3和O2,则该反应的化学方程式为 。 (4)在“反应液Ⅰ”中加KOH固体的目的是 。 A. 为下一步反应提供反应物 B. 与“反应液Ⅰ”中过量的Cl2继续反应,生成更多的KClO C. KOH固体溶解时会放出较多的热量,有利于提高反应速率 D. 使副产物KClO3转化为KCl (5)制备K2FeO4时,须将90%的Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌。采用这种混合方式的原因是 (答出1条即可)。 (6)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有 (写化学式)。 (7)工业上常用“间接碘量法”测定高铁酸钾样品中高铁酸钾的含量,其方法是:用碱性的碘化钾溶液(pH为11~12)溶解3.96 g高铁酸钾样品,调节pH为1,避光放置40分钟至反应完全(高铁酸根离子全部被还原成铁离子),再调节pH为3~4(弱酸性)。以1.0 mol·L-1的硫代硫酸钠标准溶液为滴定剂进行滴定(2Na2S2O3+I2===Na2S4O6+2NaI),当达到滴定终点时,用去硫代硫酸钠标准溶液15.00 mL,则原高铁酸钾样品中高铁酸钾的质量分数为 。
|
|
| 28. | 详细信息 |
|
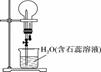
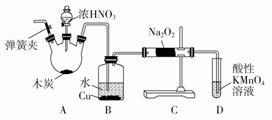
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示(A中加热装置省略)。
已知:室温下,①2NO+Na2O2===2NaNO2;②3NaNO2+3HCl===3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO 请按要求回答下列问题: (1) A装置中反应的化学方程式为 。 (2) B装置中主要的现象是 。 (3) 检验C装置产物中有亚硝酸钠的方法是 。 (4)D装置中反应的离子方程式为 。 (5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和________。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为________。 (6) 检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为 (填序号) a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯c.向三颈烧瓶中滴加浓硝酸d.熄灭酒精灯e.关闭分液漏斗欧旋塞f.停止通入N2 (7)利用改进后的装置,将7.8gNa2O2完全转化为亚硝酸钠,理论上需要木炭 g
|
|

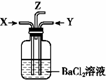 碳跟浓硫酸共热产生的气体
碳跟浓硫酸共热产生的气体