2017贵州高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列关于化学用语表示正确的是( ) A.硫离子结构示意图: C.质子数为22,中子数为26的钛原子:
|
|
| 2. | 详细信息 |
|
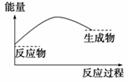
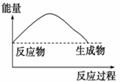
如图,表示正反应是吸热的是( )
A B. C. D.
|
|
| 3. | 详细信息 |
|
下列有关化学键的叙述,正确的是( ) A.单质分子中均存在化学键 B.离子化合物中一定含有离子键 |C.由不同种非金属元素的原子形成的共价化合物一定只含极性键 D.含有共价键的化合物一定是共价化合物
|
|
| 4. | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.1mol NH4+ 含有电子数为11NA B.18g D2O中含有的质子数目为10NA C.标准状况下,22.4L HF中的分子数为NA D.28 g由CO和N2组成的混合物中含有原子的数目为2NA
|
|
| 5. | 详细信息 |
|
下列离子检验方法中,正确的是( ) A.检验 B.检验Al3+时,在溶液中逐滴滴入氨水至过量 C.检验NH4+ 时,在溶液中加入浓的NaOH溶液后共热,产生使湿润蓝色石蕊试纸变红的气体 D.检验Na+ 时,用光洁无锈的铁丝蘸取少量溶液后到酒精灯外焰灼烧,火焰颜色呈黄色
|
|
| 6. | 详细信息 |
|
下列各组元素性质递变情况错误的是( ) A.H、Be、B原子最外层电子数依次增多 B. P、S、Cl元素最高正化合价依次升高 C. B、C、N、O、F原子半径依次增大 D. Li、Na、K、Rb的
|
|
| 7. | 详细信息 |
|
在一定温度下,反应A2(气)+B2(气) A.单位时间生成n mol的A2同时生成n mol的AB B.容器内的总压强不随时间变化 C.单位时间生成2n mol的AB同时生成n mol的B2 D.单位时间生成n mol的A2同时生成n mol的B2
|
|
| 8. | 详细信息 |
|
某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,下列有关说法错误的是( ) A.该反应的化学方程式为3X+Y B.2 min时,反应达最大限度,而后停止反应 C.反应开始至2 min,Z的反应速率为0.05 mol·L-1·min-1 D.反应达到平衡时,压强是开始时的0.9倍
|
|
| 9. | 详细信息 |
|
硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴滴加5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示,下列说法不正确的是( ) A.反应中硝酸被还原为NH4+ B.DE段反应的离子方程式为NH4+ + OH- = NH3·H2O C.合金中铁和铝的物质的量之比为1: D.图像中C点所加NaOH溶液的体积为7mL
|
|
| 10. | 详细信息 |
|
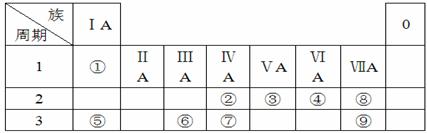
Ⅰ.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
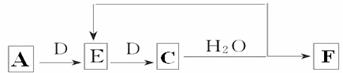
(1)⑤⑥⑧⑨的离子半径大小顺序为 _(用元素符号表示)。 (2)②③⑦的最高价氧化物对应水化物的酸性最弱的是 _(用化学式表示),实验室制备该物质的化学方程式为____________________________________________ (3)写出由①④⑤元素构成的化合物的电子式______________________,该化合物与⑥的单质反应的离子方程式为________________________________ Ⅱ.X、Y、Z、J、Q五种短周期主 (1)Q元素在周期表中的位置_______________________。 (2)元素的非金属性Z______Q(填“>”或“<”),下列各项能说明这一结 A. Q的氢化物的水溶液放置在空气中会变浑浊 B. Z的氢化物的沸点高于Q的氢化物的沸点 C.Z和Q的单质的状态 D. Z和 (3)X和Y可形成化合物A,D为Z的一种单质,若使A按下列途径完全转化为F:
①F的化学式为_________; ②用电子式表示A的形成过程为__________________________________________________。
|
|
| 11. | 详细信息 |
|
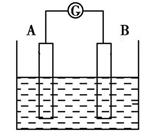
如图为原电池装置示意图。
A.铝片、铜片 B.铜片、铝片 C. 铝片、铝片 D. 铜片、铜片 写出插入稀盐酸溶液中形成的原电池的负极反应式: (2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4 (3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式: 。
|
|
| 12. | 详细信息 |
|
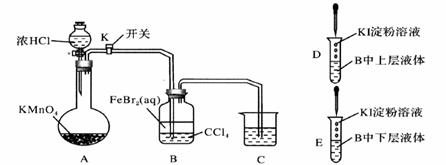
如图是卤素单质制备及相关性质检验的实验。
(1) 装置A中盛装浓HCl的仪器名称为_____________。 (2) 装置A中反应的化学 (3) 向装置B中通入过量A中产生的气体,实验完成后,将装置B中实验后的液体分离于两试管中(如图D、E),分别加入少量KI淀粉溶液,振荡。可观察到D中液体呈__________色,反应的离子方程式为_______________________________________;E中下层液体呈__________色。 (4)若将A中产生的气体与SO2按1:1的比例同时通入品红溶液中,溶液__________(填“褪色”或“不褪色”),原因为_____________________________________________(用离子方程式表示)。
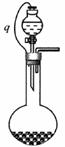
(6)为了实验能顺利进行,该老师又对发生装置A做了如右图所示的改进。橡皮管q的作用是________
|
|