辽宁省沈阳市实验中学2021-2022学年高一上学期化学10月月考试卷
辽宁省沈阳市实验中学2021-2022学年高一上学期化学10月月考试卷
教材版本:化学
试卷分类:化学高一上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高一上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列说法中有明显错误的是( )
A . 岩石的风化、溶洞的形成、矿物的形成,变化极慢,是一些在自然条件下活化能较高的反应
B . 活化分子之间发生的碰撞一定为有效碰撞
C . 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D . 增大反应物浓度,可使单位体积内活化分子数增加,因而反应速率增大
|
|
| 2. 单选题 | |
|
MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
已知,离子电荷相同时,半径越小,离子键越强。下列说法错误的是( )
A .
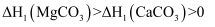 B . △H2(MgCO3)=△H2(CaCO3)>0
C .
B . △H2(MgCO3)=△H2(CaCO3)>0
C .  D . 对于MgCO3和CaCO3 ,
D . 对于MgCO3和CaCO3 , 
|
|
| 3. 单选题 | |||||
|
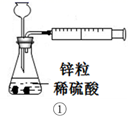
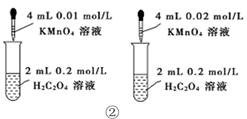
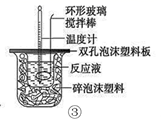
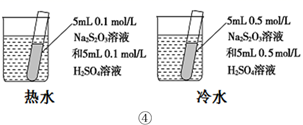
下列装置或操作能达到目的的是( )
A . 装置①用于测定生成氢气的速率
B . 装置②依据单位时间内颜色变化来比较浓度对反应速率的影响
C . 装置③进行中和反应反应热的测定实验
D . 装置④依据出现浑浊的快慢比较温度对反应速率的影响
|
|||||
| 4. 单选题 | |||||||||
|
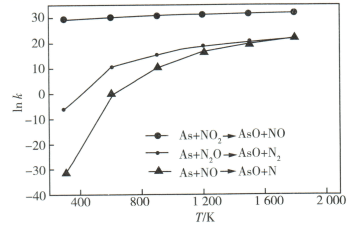
某课题组研究煤燃烧过程中氮氧化物与砷反应的微观机理,得到如下数据和图象。已知:反应速率为反应物浓度和速率常数
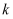 的函数, 的函数,  为活化能。对于所研究的三个反应,下列说法错误的是( ) 为活化能。对于所研究的三个反应,下列说法错误的是( )
A . 相同条件下的氧化性:
 B . 相同条件下,As与NO的反应速率最慢
C . 升高温度能增大As与
B . 相同条件下,As与NO的反应速率最慢
C . 升高温度能增大As与  反应的活化能
D . 其他条件不变,改变温度不能显著改变As与 反应的活化能
D . 其他条件不变,改变温度不能显著改变As与  的反应速率 的反应速率
|
|||||||||
| 5. 单选题 | ||||||||||||||||||||||||||||
|
Bodensteins研究反应H2(g)+I2(g)
 2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表: 2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
研究发现上述反应中:v正=ka·w(H2)·w(I2),v逆=kb·w2(HI),其中ka、kb为常数。下列说法正确的是:( )
A . 温度为T时,该反应
 B . 容器I中在前20 min的平均速率v(HI)=0.0125 mol·L-1·min-1
C . 若起始时向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行
D . 若两容器中存在kaⅠ= kaⅡ且kbⅠ= kbⅡ , 则x的值可以为任何值
B . 容器I中在前20 min的平均速率v(HI)=0.0125 mol·L-1·min-1
C . 若起始时向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行
D . 若两容器中存在kaⅠ= kaⅡ且kbⅠ= kbⅡ , 则x的值可以为任何值
|
||||||||||||||||||||||||||||
| 6. 单选题 | |
|
工业上以CO和H2为原料合成甲醇的反应:
 ,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇,如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是( ) ,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇,如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是( )
A . H2转化率:c>a>b
B . 上述三种温度之间关系为T1>T2>T3
C . a点状态下再通入
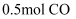 和 和  平衡向正方向移动
D . c点状态下再通入 平衡向正方向移动
D . c点状态下再通入  和 和 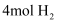 ,新平衡中 ,新平衡中  的体积分数增大 的体积分数增大
|
|
| 7. 单选题 | |
|
氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。图中表示两个常见的固氮反应:
① ②
A . 反应②为放热反应
B . 常温下,反应①的反应速率很大,而反应②的反应速率很小
C . 升高温度,反应①的反应速率增大,反应②的反应速率减小
D . 在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
|
|
| 8. 单选题 | |
|
下列叙述正确的是( )
A . 某醋酸溶液的
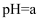 ,将此溶液稀释1倍后,溶液的pH=b,则a>b
B . 在常温下,将pH=11的某碱溶液和pH=3的某酸溶液等体积混合后,若所得溶液呈碱性,则一定是强碱与弱酸溶液反应
C . 常温下, ,将此溶液稀释1倍后,溶液的pH=b,则a>b
B . 在常温下,将pH=11的某碱溶液和pH=3的某酸溶液等体积混合后,若所得溶液呈碱性,则一定是强碱与弱酸溶液反应
C . 常温下,  盐酸的pH=3.0, 盐酸的pH=3.0,  盐酸的pH=8.0
D . 常温下,若 盐酸的pH=8.0
D . 常温下,若 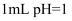 的盐酸与 的盐酸与  溶液混合后,溶液的 溶液混合后,溶液的 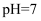 ,则NaOH溶液的 ,则NaOH溶液的 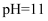
|
|
| 9. 单选题 | |
|
下列图示与对应的叙述相符的是( )
A . 图甲表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOH
B . 图乙表示常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液的滴定曲线
C . 图丙表示反应CH4(g)+H2O (g)
 CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
D . 图丁表示反应2CO(g)+2NO(g) CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
D . 图丁表示反应2CO(g)+2NO(g)  N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
|
|
| 10. 单选题 | |||||||||||
|
已知:
运用电离平衡常数判断不可以发生的反应有几个( ) ①HClO+Na2CO3=NaClO+NaHCO3 ②2HClO+Na2CO3=2NaClO+H2O+CO2↑ ③HClO+NaHCO3=NaClO+H2O+CO2↑ ④NaClO+CO2+H2O=NaHCO3+HClO ⑤HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- ⑥NaCN+CO2+H2O=HCN+NaHCO3
A . 5
B . 4
C . 3
D . 2
|
|||||||||||
高中化学 试卷推荐
- 2016-2017学年山东省淄博市桓台二中高三上学期期中化学试卷
- 内蒙古杭锦后旗奋斗中学2016-2017学年高三上学期化学开学考试试卷
- 广东清远市2017—2018学年高三上学期理综-化学期末考试试卷
- 2020年江苏卷化学高考试题
- 天津市武清区2017-2018学年高二上学期化学期中考试试卷
- 辽宁省锦州市滨海新区2018-2019学年高三上学期化学12月月考测试卷
- 广西壮族自治区贵港市覃塘高级中学2018-2019学年高二上学期化学9月月考试卷
- 2016-2017学年江苏省扬州市高二下学期学业水平化学模拟试卷(3月份)
- 四川省攀枝花市2018-2019学年高一上学期化学期末考试试卷
- 陕西省汉中市2020年高考理综-化学二模试卷
- 2015-2016学年江苏省连云港市东海县石榴高级中学高一上学期期中化学试卷
- 2017_2018学年高中化学人教版选修三 课时训练16离子晶体
最近更新


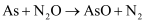

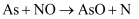

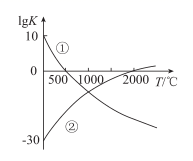

 的平衡常数
的平衡常数 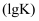 与温度的关系,根据图中的数据判断下列说法正确的是( )
与温度的关系,根据图中的数据判断下列说法正确的是( )



