2021高考真题汇编-反应速率、化学平衡
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |||||||||||||
|
取50 mL过氧化氢水溶液,在少量I- 存在下分解:2H2O2=2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:
下列说法错误的是( )
A . 反应20min时,测得O2体积为224mL(标准状况)
B . 20~40min,消耗H2O2的平均速率为0.010mol·L-1·min-1
C . 第30min时的瞬时速率小于第50min时的瞬时速率
D . H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解
|
|||||||||||||
| 2. 单选题 | |
|
实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法错误的是( )
A . 图中实线表示pH随加水量的变化,虚线表示pH随温度的变化'
B . 将NH4Cl溶液加水稀释至浓度
 mol·L-1 , 溶液pH变化值小于lgx
C . 随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小
D . 25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH mol·L-1 , 溶液pH变化值小于lgx
C . 随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小
D . 25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH  ) )
|
|
| 3. 单选题 | |
|
在298.15 K、100 kPa条件下,N2(g) +3H2 (g)=2NH3(g) ΔH=-92.4 kJ·mol-1 , N2 (g) 、H2(g)和NH3(g)的比热容分别为29.1、28.9和35.6J·K-1·mol-1。一定压强下,1 mol反应中,反应物[N2(g) +3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是( )
A .
 B .
B .  C .
C .  D .
D . 
|
|
| 4. 单选题 | |||||||||||||||||||||
|
下列方案设计、现象和结论都正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 5. 综合题 | |
|
“氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:
|
|
| 6. 综合题 | |
|
一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
|
|
| 7. 单选题 | |
|
室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是( )
A . 0~30min时间段内,Y的平均反应速率为6.67×10-8mol•L-1•min-1
B . 反应开始后,体系中Y和Z的浓度之比保持不变
C . 如果反应能进行到底,反应结束时62.5%的M转化为Z
D . 反应①的活化能比反应②的活化能大
|
|
| 8. 单选题 | |
|
常温下,用
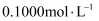 的盐酸分别滴定20.00mL浓度均为 的盐酸分别滴定20.00mL浓度均为 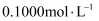 三种一元弱酸的钠盐 三种一元弱酸的钠盐  溶液,滴定曲线如图所示。下列判断错误的是( ) 溶液,滴定曲线如图所示。下列判断错误的是( )
A . 该
 溶液中: 溶液中:  B . 三种一元弱酸的电离常数:
B . 三种一元弱酸的电离常数:  C . 当
C . 当  时,三种溶液中: 时,三种溶液中:  D . 分别滴加20.00mL盐酸后,再将三种溶液混合:
D . 分别滴加20.00mL盐酸后,再将三种溶液混合: 
|
|
| 9. 多选题 | |
|
已知:
 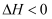 ,向一恒温恒容的密闭容器中充入 ,向一恒温恒容的密闭容器中充入  和 和  发生反应, 发生反应, 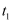 时达到平衡状态I,在 时达到平衡状态I,在  时改变某一条件, 时改变某一条件,  时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( ) 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
A . 容器内压强不变,表明反应达到平衡
B .
 时改变的条件:向容器中加入C
C . 平衡时A的体积分数 时改变的条件:向容器中加入C
C . 平衡时A的体积分数  : :  D . 平衡常数K:
D . 平衡常数K: 
|
|
| 10. 单选题 | |
|
铁的配合物离子(用
 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示: 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示: 下列说法错误的是( )
A . 该过程的总反应为
 B .
B .  浓度过大或者过小,均导致反应速率降低
C . 该催化循环中 浓度过大或者过小,均导致反应速率降低
C . 该催化循环中  元素的化合价发生了变化
D . 该过程的总反应速率由Ⅱ→Ⅲ步骤决定 元素的化合价发生了变化
D . 该过程的总反应速率由Ⅱ→Ⅲ步骤决定
|
|
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 北京市丰台区2017-2018学年高考理综-化学二模考试试卷
- 备考2018年高考化学一轮基础复习:专题21 化学反应的方向和限度
- 吉林省长春市九台区师范高级中学2019-2020学年高二下学期化学月考试卷
- 辽宁省沈阳市郊联体2017-2018学年高一下学期化学期中考试试卷
- 高中化学人教版(2019)必修第二册第六章 第一节 化学反应与能量变化
- 2015-2016学年广东省深圳高中皇御苑学校高二下学期期中化学试卷
- 高中化学人教版 选修四 第一章 化学反应与能量 第二节 燃烧热 能源
- 吉林省长春市第151中学2019-2020学年高二上学期化学期中考试试卷
- 河北省石家庄市2020年高考化学二模试卷
- 2019年高考化学真题分类汇编专题09:实验化学
- 2016年高考理综真题试卷(化学部分)(北京卷)


 2NOCl(g)+I2(g) KP1
2NOCl(g)+I2(g) KP1
 和lgKP2
和lgKP2 







