四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题
四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列生产生活中的变化或应用与氧化还原反应无关的是( )
A . 铁盐净水
B . 煤气化
C . 液态油脂变奶油
D . 蓄电池放电
|
|
| 2. 单选题 | |
|
有机物a、b、c的结构简式如下所示,下列说法错误的是( )
A . a、b、c中均只含一种官能团
B . a、b、c均能发生加成反应和被酸性高锰酸钾氧化
C . b中与苯环直接相连的原子都在同一平面上
D . c存在芳香族异构体
|
|
| 3. 单选题 | |
|
设NA为阿伏加德罗常数的值,下列叙述错误的是( )
A . 1L0.2mol/L硫酸铁溶液中含有的SO
 数目为0.6NA
B . 1molCnH2n含有的共用电子对数为(3n+1)NA
C . 电解精炼Cu时,若阴极质量增加64g,则电路中转移电子数为2NA
D . 1mol丙烯和乙烷的混合物完全燃烧生成水分子数为3NA 数目为0.6NA
B . 1molCnH2n含有的共用电子对数为(3n+1)NA
C . 电解精炼Cu时,若阴极质量增加64g,则电路中转移电子数为2NA
D . 1mol丙烯和乙烷的混合物完全燃烧生成水分子数为3NA
|
|
| 4. 单选题 | |||||||||||||||||||||
|
除去下列物质中的杂质,所选的试剂与分离方法不能达到目的的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 5. 单选题 | |
|
a、b、c、d、e是原子序数依次增大的短周期元素,a的最外层电子数是内层电子数的三倍,上述元素中b原子半径最大,a与e形成的多种化合物中一种可用于自来水消毒杀菌,c、d原子序数为奇数。下列说法正确的是( )
A . 元素非金属性:a>e
B . d、e不能形成各原子均达8e—结构的化合物
C . 工业上电解c、e形成的化合物制c的单质
D . a、b、e形成的化合物均呈碱性
|
|
| 6. 单选题 | |
|
下列实验对应的离子方程式书写正确的是( )
A . ①:H2S+CO
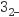 =S2-+H2O+CO2
B . ②:2Al3++3SO =S2-+H2O+CO2
B . ②:2Al3++3SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C . ③:SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C . ③:SO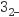 +Cl2+H2O=SO +Cl2+H2O=SO +2Cl-+2H+
D . ④:2Cl-+2H2O +2Cl-+2H+
D . ④:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
|
|
| 7. 单选题 | |
|
用0.100mol/LNaOH溶液滴定20.00mLcmol/L二元酸H2A溶液,滴定曲线如图所示,下列叙述正确的是( )
A . HA—的电离常数的数量级是10-5
B . a点:c(HA-)>c (Na+)>c(H+)>c(A2-)>c(OH-)
C . b点:c(H+)=c(A2-)+c(OH-)
D . c点:c(Na+)<c(HA-)+2c(A2-)
|
|
| 8. 实验探究题 | |
|
氨是重要的化工原料,回答下列问题:
|
|
| 9. 综合题 | |
|
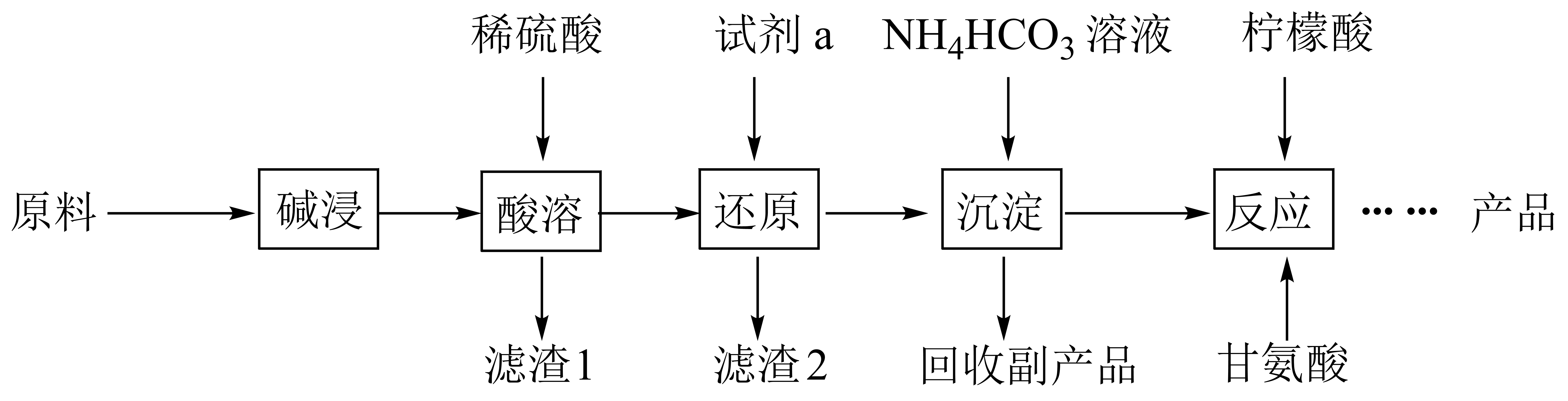
甘氨酸亚铁[(H2NCH2COO)2Fe]是一种补血剂,工业上用赤铁矿(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。 回答下列问题:
|
|
| 10. 综合题 | |
|
SO2是一种污染性气体,减少SO2在大气中的排放是环境保护的重要内容回答下列问题:
|
|
最近更新






 CO2(g)+S(g),可减少SO2在大气中的排放,在密闭容器中投入足量的反应物,不同实验条件下达到平衡,测得T=600℃下的x(SO2)—p和p=105Pa下—1gKc—t如图所示[x(SO2)表示SO2平衡时含量,Kc表示平衡常数]。该反应的正反应是反应(填“放热”、“吸热”),理由是。
CO2(g)+S(g),可减少SO2在大气中的排放,在密闭容器中投入足量的反应物,不同实验条件下达到平衡,测得T=600℃下的x(SO2)—p和p=105Pa下—1gKc—t如图所示[x(SO2)表示SO2平衡时含量,Kc表示平衡常数]。该反应的正反应是反应(填“放热”、“吸热”),理由是。
 不变
不变



