广东省2020年高考理综-化学一模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
2019年是中华人民共和国成立70周年。近年来,我国在科技方面的成果举世瞩目。下列说法不正确的是( )
A . 港珠澳大桥水下钢柱镶铝块防腐是运用了牺牲阳极的阴极保护法原理
B . “蛟龙号”潜水器所使用的钛合金材料具有强度大、密度小、耐腐蚀等特性
C . 华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
D . 高铁座椅内填充的聚氨酯软质泡沫属于有机高分子材料
|
|
| 2. 单选题 | |
|
单萜类化合物香叶醇是香精油的主要成分之一。在酸性溶液中,香叶醇可以转化为环状单萜α—松油醇:
关于香叶醇和α—松油醇,下列说法正确的是( )
A . 两者互为同分异构体,分子式是C10H20O
B . 两者分子中所有碳原子均处于同一平面
C . 两者均能在铜丝催化下和氧气氧化生成醛
D . 两者均能使溴的四氯化碳溶液褪色,发生加成反应
|
|
| 3. 单选题 | |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,由这四种元素形成的一种盐溶液,遇到FeCl3溶液呈现血红色,该盐溶液与NaOH在加热条件下会生成一种能使湿润的红色石蕊试纸变蓝的气体。下列说法正确的是( )
A . W和X形成的化合物在常温下均为气态
B . X元素可以形成多种具有广泛用途的单质
C . X和Z的最高价氧化物对应水化物都是强酸
D . Y的简单离子与Z的简单离子具有相同的电子层结构
|
|
| 4. 单选题 | |
|
实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )
A . 仪器a的名称是恒压滴液漏斗
B . 长玻璃导管可以起到冷凝回流的作用
C . 配制混酸时应在烧杯中先加入浓硫酸
D . 分离出硝基苯的主要操作是分液和蒸馏
|
|
| 5. 单选题 | |
|
钾(K)资源丰富,成本低廉,用其制作的钾离子电池有着超越锂离子电池的发展前景。我国科研人员在钾离子电池的研发上做出了巨大的贡献。如图是我国某科研团队研制的一种钾离子电池充电时的示意图,下列说法不正确的是( )
A . 放电时,外电路电子由电极a流向电极b
B . 钾离子电池电解液一般选择有机溶剂,但会有一定的安全隐患
C . 充电时,每当外电路中转移1mole- , 正极材料会“释放”39gK+
D . 充电时,电极b上的电极反应式为:WS2+xK++xe-=KxWS2
|
|
| 6. 单选题 | |
|
氮化硅(Si3N4)是一种重要的结构陶瓷材料,可用作LED的基质材料,通过等离子法由SiH4(沸点-111.9℃)与氨气反应制取的方程式如下:3SiH4+4NH3=Si3N4+12H2。设NA是阿伏加德罗常数的值,下列说法正确的是( )
A . 常温常压下,1.8gSiH4所含质子的数目为3.2NA
B . 标准状况下,4.48LNH3和H2的混合气体所含分子总数为0.2NA
C . NA个NH3分子溶于1L的水,所得溶液的物质的量浓度为1mol·L-1
D . 当生成1molSi3N4时,转移电子数目为6NA
|
|
| 7. 单选题 | |
|
低浓度的氢氟酸是一元弱酸,存在下列两个平衡:HF
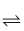 H++F- , HF+F- H++F- , HF+F- 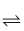 HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( ) HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
A . c(HF)+c(F-)=2.0amol·L-1
B . c(F-)>c(HF)时,溶液一定呈碱性
C . 随着溶液pH增大,
 不断增大
D . 25℃时,HF的电离常数Ka=10-3.45 不断增大
D . 25℃时,HF的电离常数Ka=10-3.45
|
|
| 8. 综合题 | |||||||||||||||||||||
|
纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。如图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:
回答下列问题:
|
|||||||||||||||||||||
| 9. 综合题 | |
|
镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
|
|
| 10. 综合题 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






 Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是(填化学式),放电时若生成73gCd(OH)2 , 则外电路中转移的电子数是。
Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是(填化学式),放电时若生成73gCd(OH)2 , 则外电路中转移的电子数是。

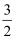 O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1




