高中化学人教版(2019)选择性必修1第三章第三节盐类的水解
高中化学人教版(2019)选择性必修1第三章第三节盐类的水解
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 实验探究题 | |
|
硼氢化钠(NaBH4)是有机合成中常用的还原剂。一种制备硼氢化钠工艺如下(部分条件和产物省略):
已知:MgH2、NaBH4遇水蒸气剧烈反应并放出H2。 回答下列问题:
|
|
| 2. 实验探究题 | ||||||||||||||||||||||||
|
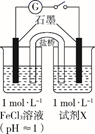
某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
|
||||||||||||||||||||||||
| 3. 填空题 | |
|
今有①CH3COOH
②HCl ③H2SO4三种溶液,用序号回答问题:
|
|
| 4. 填空题 | |
|
泡沫灭火器反应原理(硫酸铝溶液和碳酸氢钠溶液)请用离子方程式表示 。
|
|
| 5. 填空题 | |
|
在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中c(NH4*)=c(Cl-),则溶液显性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb =
|
|
| 6. 多选题 | |
|
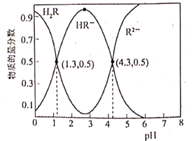
常温下,已知Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是( )
A . H2R的二级电离常数Ka2的数量级为10-5
B . 在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-)
C . 等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R)
D . 向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-
|
|
| 7. 多选题 | |
|
酸和碱的稀溶液发生反应的变化曲线如图所示,下列说法正确的是( )
A . 该反应是放热反应
B . a点可表示等物质的量的一元酸与一元碱完全反应
C . 从反应开始到a点溶液导电能力一直增强
D . 反应结束后,可利用
 来计算反应热 来计算反应热
|
|
| 8. 多选题 | |
|
常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )
A . b不可能显碱性
B . a可能显酸性或碱性
C . a不可能显酸性
D . b可能显碱性或酸性
|
|
| 9. 综合题 | |
|
常温下,如果取0.1 mol/LHA溶液与0.1 mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:
|
|
| 10. 单选题 | |
|
下列事实能用同一原理解释的是( )
A . 向NaHCO3溶液中加入AlCl3溶液或NaAlO2溶液,均生成白色沉淀
B . 向BaCl2溶液中通入SO2 , 再加入氯水或氨水,均产生白色沉淀
C . 向蛋白质溶液中加入饱和NaCl或BaCl2溶液,均产生白色沉淀
D . 用洁净铂丝分别蘸取烧碱或纯碱在外焰上灼烧,火焰均呈黄色
|
|
最近更新

 。
。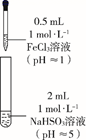
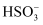
 Fe(OH)3 +3SO2;②。
Fe(OH)3 +3SO2;②。 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化: